Содержание
СТРУКТУРА

Кристаллическая структура хрома
В зависимости от типов химической связи — как и все металлы хром имеет металлический тип кристаллической решетки, то есть в узлах решетки находятся атому металла.
В зависимости от пространственной симметрии — кубическая, объемно-центрированная а = 0,28839 нм. Особенностью хрома является резкое изменение его физических свойств при температуре около 37°С. Кристаллическая решетка металла состоит из его ионов и подвижных электронов. Аналогично атом хрома в основном состоянии имеет электронную конфигурацию. При 1830 °С возможно превращение в модификацию с гранецентрированной решеткой, а = 3,69Å.
Золото Au

Золото (Au, от латинского Aurum) — химический элемент, который находится в I группе Таблицы Менделеева, входит в группу благородных металлов. К этой группе, помимо золота, относятся также серебро, платина, рутений, родий, палладий, осмий, иридий и иногда рений. Это название вышеперечисленные металлы получили благодаря высокой химической стойкости. Золото очень ценится во всем мире ещё с самых древних времен. О его особой ценности говорит тот факт, что любой средневековый алхимик считал целью своей жизни получить золото из других веществ, чаще всего в качестве исходного использовалась ртуть. Существуют легенды, что некоторым, таким как Николя Фламель, это даже удалось.
Рождение нового браузера
Что такое «Хром»? Сначала руководство корпорации «Гугл» и не помышляло о создании нового браузера, ведь ниша была уже достаточно заполнена. И откровенно говоря, творцы мощной корпорации боялись громкого провала браузера-проекта. Но, обладая мощными финансовыми возможностями, они решили все же попробовать набросать проект и вынести его на суд руководства. Как ни странно, он был одобрен — благодаря простоте, понятности и приятному пользованию.
Осенью 2008 года выходит первая версия браузера «Гугл Хром» для операционной системы Windows. Благодаря огромному бюджету, вложенному в новое детище, браузер быстро преодолевает путь от никому не известного до очень популярного.
ПРИМЕНЕНИЕ

Хромированная сталь
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов. Использование Хрома основано на его жаропрочности, твердости и устойчивости против коррозии. Больше всего Хрома применяют для выплавки хромистых сталей. Алюмино- и силикотермический Хром используют для выплавки нихрома, нимоника, других никелевых сплавов и стеллита. Значительное количество Хрома идет на декоративные коррозионно-стойкие покрытия. Широкое применение получил порошковый Хром в производстве металлокерамических изделий и материалов для сварочных электродов. Хром в виде иона Cr3+ — примесь в рубине, который используется как драгоценный камень и лазерный материал. Соединениями Хрома протравливают ткани при крашении. Некоторые соли Хрома используются как составная часть дубильных растворов в кожевенной промышленности; PbCrO4, ZnCrO4, SrCrO4 — как художественные краски. Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Хром (англ. Chromium) — Cr
| Молекулярный вес | 52.00 г/моль |
| Происхождение названия | от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений. |
| IMA статус | действителен |
Химические свойства
Как говорит история, такой элемент, как золото было известно людям еще задолго до того, как оно было установлено в таблице Менделеева. Но даже в таблице этот элемент имеет большое значение. На протяжении многих столетий разные химики в разное время проводили над этим материалом свои эксперименты. Было выяснено, что сера, а также кислород негативно влияют на большинство основных металлов. Но ученые установили, что на золото эти вещества никаким образом не воздействуют. Небольшому влиянию подвергаются только те атомы, которые находятся на поверхности.
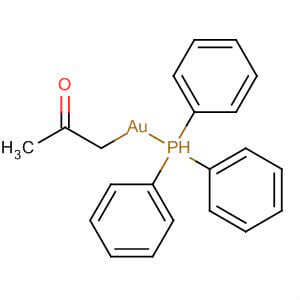
Если знать содержание ископаемого, то можно определить все его свойства и характеристики. Если с одними химическими элементами реакция не происходит, то с некоторыми происходит воздействие даже при комнатной температуре. Минеральные кислоты не имеют никакого влияния на золото. Именно по такому принципу определяют, является ли металл настоящим. Также существует свой определенный процесс, который помогает определить, подлинным и является то или иное ювелирное изделие. Для этого предмет необходимо полностью поместить в азотную кислоту.
Если украшение настоящее, то даже при взаимодействии с кислотой, цвет не поменяется. Но если вместо золота находится совершенно другой металл, то может произойти химическая реакция.
Источник
Химические свойства
Ионный обмен
При высокой температуре и pH в диапазоне от 283 до 383 К и pH 4-7, соответственно, уравновешенный раствор КОН / HCl, нерастворимое твердое вещество CrPO 4 и водный раствор катионов дают реакцию сорбции. Исследования показывают, что CrPO 4 катализирует адсорбцию двухвалентных катионов на своей аморфной поверхности по механизму катионного обмена. Механизм предполагает, что ионы H + высвобождаются из твердой фазы в водную по мере того, как катионы гидролизуются и адсорбируются на поверхности катализатора. Таким образом, снижение pH реакции используется как прямой индикатор скорости адсорбции в реакции:
График уравнения Курбатова используется для связи высвобождения иона H + с константой равновесия реакции:
где Kd (l g-1) представляет собой коэффициент распределения, а n представляет собой наклон прямой линии, указывающий на стехиометрию H + / M z + реакции обмена. В аналогичных условиях селективность CrPO 4 в отношении дативных катионов следует последовательности: Pb 2+ > Cu 2+ > Ni 2+ ≅ Cd 2+ . Повышение температуры и pH усиливает реакцию ионного обмена.
Фосфат хрома (III) также используется для катализирования катионного обмена в реакциях сорбции. Этот катализ широко используется для снижения токсичности металлов во время очистки окружающей среды. Это применялось для снижения концентрации свинца в водной среде обитания и питьевой воде.
Браузер «Гугл Хром». Что это такое
Браузер «Хром» от корпорации «Гугл» разработан на основе свободного браузера Chromium, являющего «отцом» многих существующих браузеров. Разработчиками программы было принято решение использовать в основе ее работы движок Webkit, но в 2013 году браузер «Гугл Хром» переходит на движок Blink.
Сейчас браузер «Гугл Хром» позиционирует себя как простой, быстрый и безопасный программный продукт. Безусловно, он доказывает это своей популярностью, удобным, не загроможденным интерфейсом, высоким уровнем безопасности, о котором можно вести речь отдельно, множеством приложений и расширений на любой вкус. Можно также отметить, что такой браузер, как «Хром», не стоит на месте, постоянно совершенствуя свои многочисленные сервисы.
Атом и молекула хрома. Формула хрома. Строение хрома:
Хром (лат. Chromium, от греч. χρῶμα – «цвет», «краска») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cr и атомным номером 24. Расположен в 6-й группе (по старой классификации – побочной подгруппе шестой группы), четвертом периоде периодической системы.
https://youtube.com/watch?v=ODFNQIn39JI
Хром – амфотерный металл. Относится к группе переходных металлов. Относится к чёрным металлам.
Хром обозначается символом Cr.
Как простое вещество хром при нормальных условиях представляет собой твёрдый металл голубовато-белого цвета.
Молекула хрома одноатомна.
Химическая формула хрома Cr.
Электронная конфигурация атома хрома 1s2 2s2 2p6 3s2 3p6 3d5 4s1. Потенциал ионизации (первый электрон) атома хрома равен 652,87 кДж/моль (6,76651(4) эВ).
Строение атома хрома. Атом хрома состоит из положительно заряженного ядра (+24), вокруг которого по четырем оболочкам движутся 24 электрона. При этом 23 электрона находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку хром расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома хрома на 3d-орбитали находится пять неспаренных электронов. На внешнем энергетическом уровне атома хрома – на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома хрома состоит из 24 протонов и 28 нейтронов.
Радиус атома хрома (вычисленный) составляет 166 пм.
Атомная масса атома хрома составляет 51,9961(6) а. е. м.
Химические свойства хрома
- при t=300°C реагирует с кислородом: 4Cr + 3O2 = 2Cr2O3;
- при t>300°C реагирует с галогенами, образуя смеси галогенидов;
- при t>400°C реагирует с серой, с образованием сульфидов: Cr + S = CrS;
- при t=1000°C тонкоизмельченный хром реагирует с азотом, образуя нитрид хрома (полупроводник, обладающий высокой химической устойчивостью): 2Cr + N2 = 2CrN;
- реагирует с разбавленными соляной и серной кислотами с выделением водорода:
Cr + 2HCl = CrCl2 + H2; Cr + H2SO4 = CrSO4 + H2; - теплые концентрированные азотная и серная кислоты растворяют хром.
С концентрированными серной и азотной кислотой при н.у. хром не взаимодействует, также не растворяется хром и в царской водке, примечательно, что чистый хром не вступает в реакцию даже с разбавленной серной кислотой, причина этого феномена до сих пор не установлена. При длительном хранении в концентрированной азотной кислоте хром покрывается очень плотной оксидной пленкой (пассивируется), и перестает реагировать с разбавленными кислотами.
Оксид
В земной коре и на просторах Вселенной существует множество химических соединений, которые отличаются по классам, типам, характеристикам. Одним из самых распространенных видов соединений является оксид (окись, окисел). К нему относят песок, воду, углекислый газ, т. е. основополагающие вещества для существования человечества и всей биосферы Земли. Оксидами называют вещества, которые имеют в составе атомы кислорода со степенью окисления -2, при этом связь между элементами является бинарной. Их образование происходит в результате химической реакции, условия которой разнятся в зависимости от состава оксида.
Характерными признаками данного вещества являются три позиции: вещество сложное, состоит из двух атомов, один из них – кислород. Большое количество существующих оксидов объясняется тем, что многие химические элементы образуют несколько веществ. Они идентичны по составу, но атом, вступающий в реакцию с кислородом, проявляет несколько степеней валентности. Например, оксид хрома (2, 3, 4, 6), азота (1, 2, 3, 4 ,5) и т. д. При этом их свойства зависят от степени валентности элемента, вступающего в окислительную реакцию.
По принятой классификации оксиды бывают основными и кислотными. Также выделяется амфотерный вид, который проявляет свойства основного окисла. Кислотные оксиды – это соединения неметаллов или элементов с высокой валентностью, их гидратами являются кислоты. К основным окислам относят все вещества, имеющие связь кислород + металл, их гидратами являются основания.

Распространение золота в природе
Золото не очень сильно распространено на нашей планете, но и не является редкостью, содержание его в литосфере около 4,3·10 -7 %, а в одном литре морской воды его содержится около 4·10 -9 г. Некоторое количество золота находится в почве, оттуда его получают растения. Кукуруза является отличным источником природного золота для питания человека, это растение имеет способность концентрировать его в себе. Добыча золота крайне сложное занятие, именно за счет этого оно и имеет такую высокую цену. Как говорят геологи, «золото любит одиночество», т.к. чаще всего его находят в виде самородков, т.е. оно находится в руде в чистом виде. Лишь в крайне редких случаях встречаются соединения золота с висмутом и селеном. Очень небольшое его количество имеется в магматических горных породах, в застывшей лаве. Но из них добыть золото стоит еще большего труда, а содержание его очень низкое. Поэтому способ добычи из магматических пород не находит применения ввиду своей нерентабельности. Основные запасы золота сосредоточены в России, ЮАР и Канаде.
Вредные факторы производства – главная причина отравлений
Конечно, острое отравление растворимыми солями, принятыми внутрь, в настоящее время случается очень редко, в качестве случаях клинической казуистики. Наибольшее число случаев отравления хромом и его соединениями происходит по причине его нахождение в воздухе плавильных цехов и на производстве подготовки руды. Речь идёт о загрязнении рабочей зоны колосниковых площадок, на пульте управления термическими печами, в зоне дробления породы, на узле дозировки и в других местах производства стали и сплавов.

Хромовая руда
К наличию превышения предельных допустимых концентраций этого металла и соединений, а также пыли,приводят различные нарушения герметизации технологических зон, разливка расплавленного металла, конечный этап – а именно загрузка хромовых сплавов в вагоны и их транспортировка.
Кроме пыли, профессиональные болезни на производстве вызваны не только отравлением хромом – обычно в пыли содержатся кремний, высока концентрация оксида марганца. Особо опасным фактором является аэрозоль соединений шестивалентного металла, который постоянно выделяется с расплавленной поверхности свежеотлитого металла и высокотемпературных шлаков.
Безусловно, к появлению профессиональных интоксикаций хромом и марганцем можно отнести и трудовую деятельность на дробильно-обогатительных фабриках, а также различные открытые способ добычи руды, содержащих этот металл.
Обозначение золота в таблице менделеева и его свойства
Запись обновлена: Май 26, 2020
На сегодняшний день это полезное ископаемое представляет огромную ценность в странах всего мира. Любая современная девушка мечтает о том, чтобы ей подарили украшение, которое сделано из золота. Свою популярность, ценность и спрос этот материал получил еще сотни лет назад. В древние времена это был материал для производства посуды, ювелирных изделий, одежды и прочих предметов потребления. Мы будем рассматривать золото как металл, а также, как один из многих элементов в химической таблице Менделеева.

На сегодня, приобретение предмета или украшения, изготовленного из этого благородного металла, не составляет большого труда. Многие продавцы и распространители обладают огромным ассортиментом, поэтому всегда есть выбор.
В данной статье любой желающий сможет узнать обозначение золота в природе, в промышленности, а также в таблице Менделеева.
Гидроксид хрома Cr(OH)3(III)
Физические свойства Cr(OH)3(III):
- амфотерный малоустойчивый гидроксид различной окраски (голубой, фиолетовой, зеленой), которая зависит от условий получения;
- имеет различную химическую активность;
- плохо растворим в воде.
Химические свойства Cr(OH)3(III):
- реагирует с кислотами с образованием солей:Cr(OH)3+3H2SO4 = Cr2(SO4)3+6H2O
- реагирует с щелочами с образованием комплексных соединений хрома:Cr(OH)3+NaOH = Na[Cr(OH)4]
- осаждается при действии щелочей на соли хрома:Cr(OH)3+3NaOH = Cr(OH)3↓+3NaCl
- выпавший в осадок гидрооксид хрома растворим в кислотах:Cr(OH)3+3HCl = CrCl3+3H2O
- и в избытке щелочей:Cr(OH)3+3NaOH = Na3[Cr(OH)6]
Оксид хрома CrO3(VI) (хромовый ангидрид)
Физические свойства CrO3(VI):
- кристаллы красно-фиолетового цвета;
- разлагаются при комнатной температуре;
- расплывается на воздухе по причине высокой гигроскопичности;
- хорошо растворим в воде.
Химические свойства CrO3(VI):
- CrO3(VI) является кислотным оксидом;
- растворяясь в воде, образует хромовые кислоты:
- хромовая кислота: CrO3+H2O(изб) = H2CrO4
- дихромовая кислота: 2CrO3+H2O(нед) = H2Cr2O7
- реагирует с основаниями:CrO3+2KOH = K2CrO4+H2O
- CrO3 окисляет углерод, серу, фосфор, йод, образуя оксид хрома (III):
4CrO3+3S = 3SO2+2Cr2O3 - нагретый до температуры выше 250°C, триоксид хрома разлагается на молекулярный кислород и оксид хрома (III):
4CrO3 = 2Cr2O3+3O2
Триоксид хрома получают действием концентрированной серной кислоты на концентрированные растворы хроматов/дихроматов калия/натрия:
K2Cr2O7+H2SO4 = 2CrO3↓+K2SO4+H2O
Сульфаты хрома (III)
Хорошо охарактеризованы три сульфата хрома (III):
- Безводный сульфат хрома (III) Cr 2 (SO 4 ) 3 (CAS # 10101-53-8) представляет собой твердое вещество фиолетового цвета, которое растворяется в воде при добавлении восстановителя, который образует сульфаты хрома (II).
- Гидратированный сульфат хрома (III), Cr 2 (SO 4 ) 3 · 18H 2 O, (CAS # 13520-66-6) представляет собой твердое вещество фиолетового цвета, которое легко растворяется в воде с образованием водного комплекса металла [Cr (H 2 O ) 6 ] 3+ . Формула этого соединения может быть записана более описательно как [Cr (H 2 O) 6 ] 2 (SO 4 ) 3 · 6H 2 O. Шесть из восемнадцати молекул воды в этой формульной единице представляют собой кристаллизационную воду .
- Гидратированный сульфат хрома (III) Cr 2 (SO 4 ) 3 · 15 (H 2 O) (CAS # 10031-37-5) представляет собой твердое вещество зеленого цвета, которое также легко растворяется в воде. Его получают нагреванием материала 18-гидрата выше 70 ° C. Дальнейшее нагревание дает безводный сульфат.
Известен ряд других сульфатов хрома (VI), но они также содержат гидроксидные или оксидные лиганды. Наиболее важным с коммерческой точки зрения является основной сульфат хрома , который, как считается, представляет собой [Cr 2 (H 2 O) 6 (OH) 4 ] SO 4 (CAS № 39380-78-4). Это результат частичной нейтрализации гексагидратов. Сообщалось о других гидроксидах хрома (III).
Структура Cr (SO 4 ) (H 2 O) (OH), показывающая координационную сферу CrO 6, типичную для многих соединений хрома (III).
Виды хромовых руд
Хромовые руды бывают техногенными, экзогенными и эндогенными в зависимости от типа месторождения. Россыпные (или экзогенные) добываются на месторождениях, возникших из-за разрушения эндогенных залежей хромитовых руд. Металл получают из порошковатых, рыхлых и валунчатых руд на Сарановском, Кемпирсайском месторождении и японских морских россыпях. Эндогенные руды бывают:
- Позднемагатическими. Сформированы из остаточных рудных расплавов, отличающихся высокой концентрацией ценных компонентов. Высокохромистые огнеупорные и металлургические руды добывают преимущественно в Албании, Турции и Греции.
- Раннемагматическими. Формируются на ранних стадиях кристаллизации пород магматического типа. Главными местами добычи огнеупорных среднехромистых руд являются Индия, Северная Америка и Южная Африка.
Места добычи техногенных разновидностей — спецотвалы, сформированные в процессе разработки хромовых месторождений при обогащении руд. Добыча техногенной руды считается экономически целесообразной, что делает ее наиболее востребованной в промышленной сфере.
О профилактике
Главным средством профилактики отравлений в быту является грамотное обращение с высокотоксичными препаратами, особенно растворимыми, и хранение их в местах, недоступных для детей.

На производстве – гальваническое хромирование
На производстве наилучший эффект дают технологические меры. Это герметизация аппаратуры, автоматизация на производстве, соблюдение норм принудительной вентиляции, отдельный цех для работы с соединениями хрома, обязательные условия для обезвреживания рабочих одежд после смен, ее стирка, сушки и обеспыливание. Там, где такие меры по технологическим соображениям применяться не могут, необходимо использовать респираторы, перчатки, изолирующие противогазы. Одним из главных способов медицинской профилактики является периодический медицинский осмотр согласно приказу номер 302Н, поскольку хром для человека приносит не только пользу, но и вред: он является аллергеном, канцерогеном, и элементом, соединения которого могут вызывать тяжелые отравления вплоть до летальных.
Где используется
Металл используется по двум направлениям: как лигатура к другим металлам и как покрытие.
Металлургия
Отрасль, забирающая три четверти объемов металла. Хромом легируют стали для улучшения кондиций.
Получают продукт:
- нержавеющий;
- износостойкий;
- жаропрочный.
Такие достоинства сталей обусловили их применение как материала стволов артиллерии, корпусов субмарин, сейфов, металлорежущего, медицинского, химического инструментария. Из них выполнены двигатели космических кораблей, начинка плазмотронов.
Самые известные хромсодержащие сплавы – с никелем (нихром) и железом (фехраль). Это прецизионные материалы с повышенным электрическим сопротивлением. Используются для работы при экстремальных температурах.

Другие отрасли промышленности
Продукция из металла и сплавов с ним выпускается для разных сегментов рынка:
- Кирпичи – корпус металлургических печей.
- Нагревательные элементы (сплав с никелем).
- Хирургический инструментарий (сплав с никелем, молибденом, кобальтом).
- Соединения хрома пригождаются при производстве спичек, обуви, одежды (знаменитая блестяще-прочная хромовая кожа), окраске текстиля, обработке мебельной древесины.
- Зеленую хромовую краску наносят на керамику перед покрытием глазурью и обжигом.
- Трехвалентный оксид металла – исходник при выращивании синтетических рубинов для лазеров.
- Зеленые огни салюта – заслуга хрома.
Хром закупают фармацевтические гиганты, производители биодобавок, препаратов для похудения.
Декор
Хромированное покрытие корпуса часов либо деталей авто – не только маркер статусности. Такая обработка защищает от износа, коррозии, механических повреждений.
Толщина покрытия металлом зависит от назначения изделия: от 2 мкм (декоративный ассортимент) до 0,1 мм (детали байков, велосипедов, авто).
Симптомы острого и хронического отравления
Как и при любой другой интоксикации, симптомы отравления хромом будут зависеть от пути попадания внутрь или на кожу, от времени контакта, и от валентности. Чем она выше у атома в соединении, тем признаки отравления хромом тяжелее. Существует острая и хроническая интоксикация.
При остром отравлении в организм чаще всего попадают большие дозы шестивалентного хрома. Если средство принято внутрь (например, раствор дихромата калия), то одним из характерных симптомов является сильнейшие боли в эпигастрии и в животе, симптомы желудочно-кишечного кровотечения, которое в тяжелых случаях осложняется перфорацией кишечника.
Через некоторое время в поджелудочной железе и печени развиваются участки омертвения, у пациента развивается гемолиз крови и синдром диссеминированного внутрисосудистого свертывания (ДВС).
Возникает олигурия, а затем анурия, появляется острая токсическая почечная недостаточность, вследствие некроза паренхимы почек.
Такие случаи тяжелейших отравлений требуют неотложных реанимационных мероприятий и часто, несмотря на все усилия врачей, приводят к смерти.
Если соединения воздействуют на кожу, то они приводят к тяжелым токсическим дерматитам с образованием язв, но вследствие высокой окислительной способности соединения через кожу не всасываются, если нанесены на небольшой площади, поскольку контактируют с белками и коагулируют их, обладая подсушивающим и вяжущим, дубящим действием. Это спасает подкожную клетчатку и внутренние органы от трансдермального пути передачи. Однако, в том случае, если 10% всей поверхности кожи поражено (чуть больше площади одной ладони, или более 9%), то могут развиться и общие признаки интоксикации.
При длительном контакте соединений с кожей развивается аллергия на хром. Дерматит протекает в виде длительно текущего контактного и аллергического поражения кожи, с экссудацией, корками, мокнутием и образованием хронических, незаживающих язв. В клинике известны так называемые «хромовые ожоги», так называют язвы, которые рубцуются и после которых возникают шрамы, они появляются при контактном дерматите у рабочих в красильной промышленности. Аллергия на хром и кобальт может возникать в ортодонтии, при ношении зубных коронок без предварительной аллергической пробы.
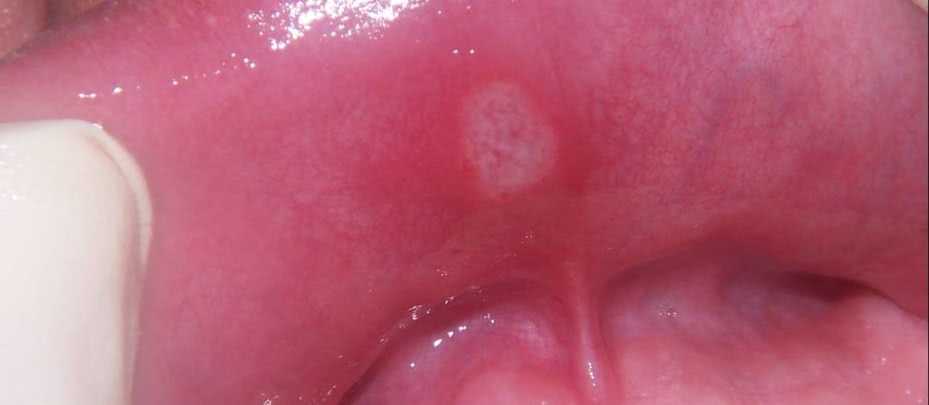
Стоматитная язвочка
Симптомы аллергии проявляются в виде возникновения стоматитов, иногда с изъязвлением. При подтверждении диагноза протезы обязательно следует снимать.
Соединения шестивалентного хрома могут вызывать тяжелую интоксикацию при вдыхании. Он раздражает носоглотку и бронхи, в перегородке носа появляются язвы и перфорация. Уже через несколько часов возникает кашель и одышка, а при длительном контакте шестивалентный хром вызывает рак легких, по некоторым данным – уже через два года после работы с нарушением правил техники безопасности.