Содержание:
В молекулярный кислород или дикислород, также называемый двухатомным или газообразным кислородом, является наиболее распространенной формой элемента, в которой этот элемент встречается на планете Земля. Его формула O2, следовательно, являясь двухатомной и гомоядерной молекулой, полностью неполярной.
Воздух, которым мы дышим, на 21% состоит из кислорода в виде молекул O.2. По мере подъема концентрация газообразного кислорода уменьшается, а присутствие озона увеличивается, O3. Наше тело пользуется преимуществом O2 насыщать кислородом ваши ткани и осуществлять клеточное дыхание.

О2 Он также ответственен за существование огня: без него было бы почти невозможно возгорание и возгорание. Это связано с тем, что его основным свойством является то, что он является мощным окислителем, приобретает электроны или восстанавливается в молекуле воды или оксидных анионах O2-.
Молекулярный кислород необходим для бесчисленных аэробных процессов, применяемых в металлургии, медицине и очистке сточных вод. Этот газ практически является синонимом тепла, дыхания, окисления и, с другой стороны, температуры замерзания, когда он находится в жидком состоянии.
Простота применения
Кислородный «допинг» может помочь снять стресс и повысить работоспособность в моменты пиковых нагрузок, более эффективно провести спортивную тренировку и не уснуть за рулем. Для каждого случая — свои рекомендации, выполнение которых не требует специальных навыков и изменения привычного распорядка дня, ведь баллончик всегдаё может быть под рукой. Применять баллончики с кислородом очень просто:
- Открыть крышку на баллончике.
- Если в комплект входит маска, присоединить ее к клапану.
- Поднести баллончик или маску к лицу на расстояние 3–5 см.
- Нажать на клапан и сделать стандартный по продолжительности вдох за 1–2 секунды, что соответствует 150–200 мл газовой смеси.
- Повторить надо несколько вдохов. Обычно пяти вдохов бывает достаточно для компенсации дефицита кислорода в организме.
- Закрыть крышку баллончика до следующего использования.
- Можно повторить процедуру через некоторое время в зависимости от самочувствия.
Важно помнить, что баллончики KISLOROD — это медицинское изделие, которое находится в свободной продаже и не требуют рецепта. Большой спектр применимости делает продукт востребованным среди покупателей
Добавление его в ассортимент вашей аптеки не приводит к «каннибализации продаж» других медицинских изделий, а только расширяет возможность получения дополнительного дохода.
При этом покупка баллончиков KISLOROD не наносит урон семейному бюджету: цена вполне доступная для большинства потребителей и зависит прежде всего от объема и выбранной комплектации. А если учесть, что срок годности составляет 36 месяцев с даты производства, то можно смело рекомендовать покупку кислородных баллончиков и для домашней аптечки.
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.
1 Заболеваемость населения по основным классам болезней https://rosstat.gov.ru/folder/13721
Кислород
Кислоро́д — элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов, с атомным номером 8. Обозначается символом O (лат. Oxygenium).
Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов.
Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон (CAS-номер: 10028-15-6) — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
История открытия
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота.
Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле.
Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В.
Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч.
ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим окислы, именуемые по современной международной номенклатуре оксидами.
Получение
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
также используют реакцию каталитического разложения пероксида водорода Н2О2:
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода).
К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей.
Физические свойства
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C).
Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C — 0,03 %, при 2600 °C — 1 %, 4000 °C — 59 %, 6000 °C — 99,5 %.
Жидкий кислород (темп.
кипения −182,98 °C) — это бледно-голубая жидкость.
Твёрдый кислород (темп. плавления −218,79 °C) — синие кристаллы.
Общие сведения
Кислород — это газообразный химический элемент. Он обозначается символом O, имеет атомный номер 8 и атомный вес 15,9994, а его молярная масса 32 г/моль. Формула кислорода О2. Схема электронной конфигурации атома кислорода — 1s 2 2s 2 2p 4. Строение атома кислорода имеет две оболочки, как и все элементы, расположенные во втором периоде.

Он представляет большой интерес, поскольку является важнейшим элементом дыхательных процессов большинства живых клеток и процессов сгорания. Это самый распространённый элемент в земной коре. Почти одна пятая (по объёму) воздуха — это О2. Степень окисления -2.
В нормальных условиях О2 — бесцветный газ без запаха и вкуса. Он конденсируется в светло-голубой жидкости. Это реакционноспособный элемент, который образует оксиды со всеми другими элементами, кроме гелия, неона, аргона и криптона. Он умеренно растворим в воде (30 см3 на 1 л растворяющейся воды) при температуре 20 градусов Цельсия.
Получение в лаборатории (adsbygoogle = window.adsbygoogle || []).push({});
Среди лабораторных методов широкое распространение получил метод термической обработки:
- пероксидов;
- солей кислородсодержащих кислот.
При высоких температурах они разлагаются с выделением газообразного кислорода. Катализируют процесс чаще всего оксидом марганца (IV). Собирают кислород вытеснением воды, а обнаруживают — тлеющей лучинкой. Как известно, в атмосфере кислорода пламя разгорается очень ярко.
Еще одно вещество, используемое для получения кислорода на школьных уроках химии, — перекись водорода. Даже 3 % раствор под действием катализатора мгновенно разлагается с высвобождением чистого газа. Его нужно лишь успеть собрать. Катализатор тот же — оксид марганца MnO2.
Среди солей чаще всего используются:
- бертолетова соль, или хлорат калия;
- перманганат калия, или марганцовка.
Чтобы описать процесс, можно привести уравнение. Кислорода выделяется достаточно для лабораторных и исследовательских нужд:
Почему замедлилась скорость вращения Земли
Земля 3,5 млрд лет назад вращалась с невероятно высокой скоростью, но ситуация изменилась с появлением Луны. На Землю стала действовать ее гравитация. Кроме того, возникли приливы и отливы, которые также внесли свой вклад в замедление скорости вращения планеты.

Появлению современной жизни на планете мы обязаны Луне
Первое сильное замедление Земли произошло 2,5 млрд лет назад, и оно как раз совпадает с тем периодом, когда сильно увеличилось содержание кислорода в атмосфере. В результате произошла так называемая “кислородная катастрофа”. Затем замедление вращения прекратилось примерно на один миллиард лет. Это совпало с периодом, когда ускорение роста уровня кислорода в атмосфере отсутствовало. Около 600 миллионов лет назад вновь произошло замедление скорости вращения планеты, и в этот период времени также отмечается скачок уровня кислорода. К слову, скорость вращения нашей планеты нестабильна и по сей день. К примеру, в 2020 году было отмечено ее ускорение.
Сопоставив картину замедления вращения земли и насыщения атмосферы кислородом, ученые пришли к выводу, что между этими процессами есть взаимосвязь. Ключом к разгадке стали упомянутые выше исследования на Мидл-Айленде, которые описаны в журнале Nature Geoscience.
Из всего вышесказанного можно сделать вывод, что именно Луна стала толчком к зарождению жизни на Земле в том виде, в котором она существует сейчас. Правда, Луна повлияло лишь косвенно, непосредственное участие в синтезе кислорода принимало лишь Солнце и цианобактерии. Но парадокс в том, что Солнце может в будущем и лишить Землю кислорода, уничтожив растения и цианобактерии.
Химические свойства (adsbygoogle = window.adsbygoogle || []).push({});
О том, насколько активен рассматриваемый газ, как он ведет себя в реакциях с другими веществами, подробно рассказывает химия. Кислород способен проявлять несколько степеней окисления, хотя наиболее частой является -2, которая считается постоянной. Помимо нее встречаются соединения, в которых значения следующие:
- -1;
- -0,5;
- -1/3;
- +0,5;
- +1;
- +2.
Химическая активность объясняется высоким сродством к электрону, так как значение электроотрицательности по Поллингу у него 3,44. Выше лишь у фтора (4). Поэтому кислород является очень сильным окислителем. В тоже время в реакциях с еще более сильными окислителями ведет себя как восстановитель, проявляя положительную степень окисления. Например, в оксиде фтора O+2 F2— .
Существует огромное количество соединений, в состав которых входит кислород. Это такие классы веществ, как:
- оксиды;
- пероксиды;
- озониды;
- надпероксиды;
- кислоты;
- основания;
- соли;
- органические молекулы.
Со всеми элементами кислород способен вступать в реакцию при обычных условиях, кроме благородных металлов, гелия, неона и аргона и галогенов. С инертными газами он не взаимодействует ни при каких условиях.
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия. (Четвертый выпуск). Мак Гроу Хилл.
- Википедия. (2020). Аллотропы кислорода. Получено с: en.wikipedia.org
- Хоун, К.А., Каппе, К.О. (2019). Использование молекулярного кислорода для жидкофазного аэробного окисления в непрерывном потоке.Топ Curr Chem (Z)377, 2. doi.org/10.1007/s41061-018-0226-z
- Кевин Бек. (28 января 2020 г.). 10 видов использования кислорода. Получено с: sciencing.com
- Cliffsnotes. (2020). Биохимия I: химия молекулярного кислорода. Получено с: cliffsnotes.com
- GZ Industrial Supplies. (2020). Промышленные преимущества газообразного кислорода. Получено с: gz-supplies.com
Что происходит в процессе фотосинтеза
Как уже было сказано ранее, в ходе фотосинтеза в хлоропластах под действием солнечного света образуются органические вещества.
Процесс фотосинтеза можно разделить на две фазы:
1. Световая.
2. Темновая.
В ходе световой фазы фотосинтеза образуется энергия в виде АТФ и универсальный донор атома водорода — восстановитель НАДФН (НАДФ·Н2). Эти вещества необходимы для протекания темновой фазы. Также образуется побочный продукт — кислород. Световая фаза может проходить только на мембранах тилакоидов и на свету.
Благодаря сложному биохимическому процессу — циклу Кальвина — в темновую фазу фотосинтеза образуются органические вещества (сахара). Темновая фаза проходит в строме хлоропластов и на свету, и в темноте. Темновые ферментативные процессы протекают медленнее, чем световые, поэтому при очень ярком освещении скорость протекания фотосинтеза будет полностью определяться скоростью темновой фазы. Схемы процессов фотосинтеза представлены на рис.2. Подробное описание процессов смотри далее.
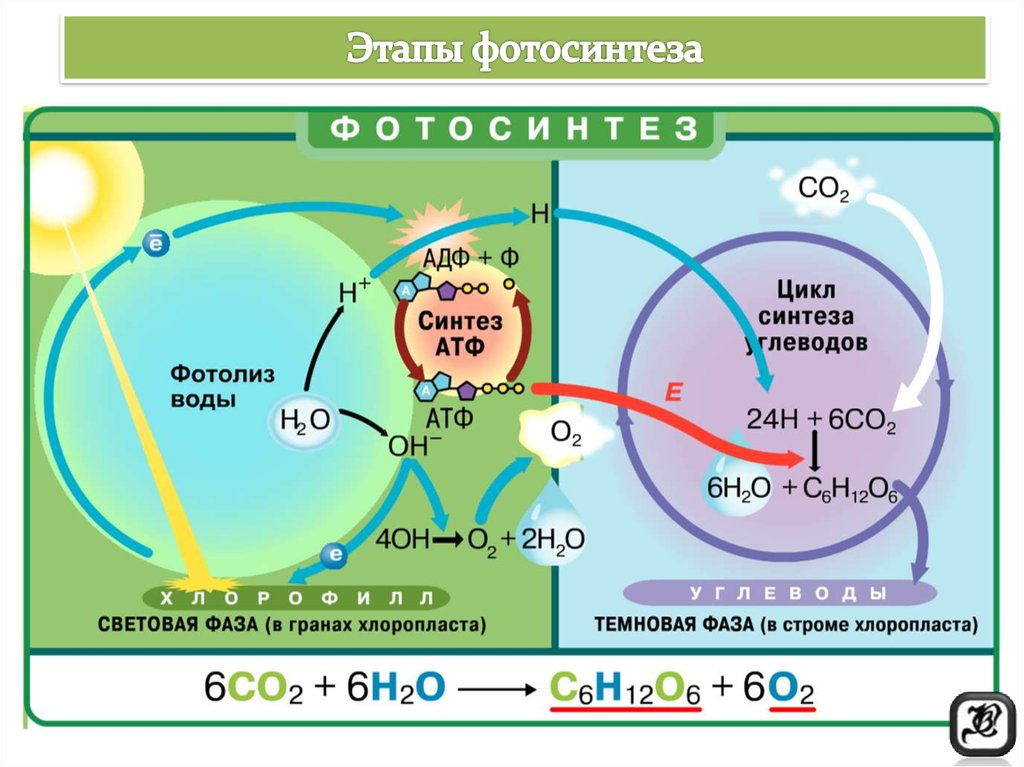 Рис.2. Схема процессов фотосинтеза и суммарное уравнение фотосинтеза.
Рис.2. Схема процессов фотосинтеза и суммарное уравнение фотосинтеза.
Кислород как простое вещество
Простое вещество кислород существует в виде молекул. Молекула кислорода состоит из двух атомов химического элемента кислорода (рис. 73), поэтому химическая формула кислорода как простого вещества — O2.
Поскольку относительная атомная масса кислорода равна 16, то относительная молекулярная масса простого вещества кислорода равна:
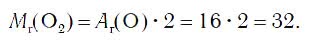
Следовательно, молярная масса кислорода равна:
Как у всех газов, молярный объем кислорода при нормальных условиях равен:
Когда говорят о кислороде как о простом веществе, то подразумевают вещество, имеющее формулу О2. Например: «Железные изделия быстро ржавеют в атмосфере влажного кислорода», «Для горения древесины необходим кислород». В этих примерах речь идет о веществе, имеющем формулу О2.
История открытия кислорода
История открытия самого важного для человека газа была долгой и запутанной. Впервые об открытии кислорода было сообщено в 1774 г
английским химиком Дж. Пристли. Он получил его при нагревании вещества HgO. Однако Дж. Пристли в то время не понял, что он получил новое газообразное вещество, и считал его разновидностью воздуха. Еще раньше в 1772 г. кислород был получен К. Шееле, но сообщение об этом он опубликовал только в 1777 г.
В 1774 г. Дж. Пристли сообщил о своих результатах великому французскому химику А. Лавуазье. Он тут же начал свои опыты и уже в 1775 г. сделал в Академии наук доклад «Мемуар о природе вещества, соединяющегося с металлами при прокаливании и увеличивающего их вес».
Происхождение названия «кислород» связано с образованием кислот в результате растворения в воде некоторых сложных веществ, содержащих атомы этого элемента. А. Лавуазье считал, что кислород — это обязательная составная часть всех кислот, что он «рождает» кислоты. Чтобы подчеркнуть это, А. Лавуазье в 1779 г. назвал этот газ «рождающим кислоты», или сокращенно — кислородом.
[править] Применение
Кислород воздуха имеет чрезвычайно важное значение для процессов горения. Сжигая различные виды топлива, получают тепло, которое используют для удовлетворения самых различных потребностей, в том числе для преобразования его в механическую и электрическую энергию
При участии кислорода воздуха сгорает топливо на теплоэлектростанциях, топливо в двигателях автомобилей, выжигают металлические руды на заводах цветной металлургии.
Сварка и резка металлов
Чистый кислород с ацетиленом широко используют для так называемой автогенной сварки стальных труб и других металлических конструкций и их резки. Для этого служит специальная горелка, который состоит из двух металлических трубок, вставленных друг в друга. В пространство между трубками пропускают ацетилен и зажигают, а затем по внутренней трубке пропускают кислород. Оба газа, подаются из баллонов под давлением. Температура в кислородно-ацетиленовом пламени — до 2000 ° C, при такой температуре плавится большинство металлов.
В медицине
Кислород — биогенный химический элемент, обеспечивающий дыхание большинства живых организмов на Земле. Физиологическое действие кислорода разностороннее, решающее значение в его лечебном эффекте имеет способность возмещать дефицит кислорода в тканях организма при гипоксии (недостаточного снабжения тканей кислородом или нарушения его усвоения).
Ингаляцией (вдыханием) кислорода широко пользуются при различных заболеваниях, сопровождающихся гипоксией (нехваткой кислорода): при заболеваниях органов дыхания (пневмония, отек легких и т. д.), сердечно-сосудистой системы (сердечная недостаточность, коронарная недостаточность, резкое падение артериального давления и т. п.), отравлениях угарным газом, синильной кислотой, удушающими веществами (хлор, фосген и др.), а также при других заболеваниях с нарушением функции дыхания и окислительных процессов.
В анестезиологической практике кислород широко применяется в смеси с ингаляционными наркотическими анальгетиками. Чистым кислородом и смесью его с углекислотой пользуются при ослаблении дыхания в послеоперационном периоде, при интоксикациях и т. д.
Широко пользуются кислородом для так называемой гипербарической оксигенации — применения кислорода под повышенным давлением. Установлена высокая эффективность этого метода в хирургии, интенсивной терапии тяжелых заболеваний, особенно в кардиологии, реаниматологии, неврологии и других областях медицины.
Применяют также энтеральную оксигенотерапию (введение кислорода в кишечник или желудок) путем введения в желудок кислородной пены, применяемой в виде так называемого кислородного коктейля. Используется для общего улучшения обменных процессов в комплексной терапии сердечно-сосудистых заболеваний, нарушений обмена веществ и других патологических состояний, связанных с кислородной недостаточностью организма.
Чистым кислородом пользуются для дыхания также летчики при высоких полетах, водолазы, на подводных лодках и т. п.
Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания.
Воздействие на здоровье
Кислород необходим для всех форм жизни, так как он является составной частью ДНК и почти всех других биологически важных соединений. В лёгких этот элемент поглощается атомом железа в центре гемоглобина в крови и, таким образом, транспортируется туда, где он необходим.

Каждый человек нуждается в этом элементе, чтобы дышать, но, как и во многих случаях, слишком большое его количество вредно. Если человек подвергается воздействию большого количества О2 в течение длительного времени, может произойти повреждение лёгких. Вдыхание 50−100% кислорода при нормальном давлении в течение длительного периода приводит к повреждению лёгких. Люди, которые работают с частым или потенциально высоким воздействием чистого элемента, должны пройти тесты на функционирование лёгких до начала работы и по завершении.
Физические свойства кислорода
При взаимодействии двух атомов кислорода образуется устойчивая молекула простого вещества кислорода O2. Данное простое вещество, как и элемент, называется кислородом. Не путайте кислород-элемент, и кислород – простое вещество!
По физическим свойствам кислород – бесцветный газ без запаха и вкуса. Практически нерастворим в воде (при комнатной температуре и нормальном атмосферном давлении растворимость кислорода составляет около 8 мг на один литр воды). Кислород растворим в воде – в 1 л воды при температуре 20°С растворяется 31 мл кислорода (0,004% по массе). Однако этого количества достаточно для дыхания рыб, живущих в водоемах. Газообразный кислород немного тяжелее воздуха:
1 л воздуха при температуре 0°С и обычном давлении весит 1,29 г, а 1 л кислорода – 1,43 г.
Кислород проявляет интересные свойства при сильном охлаждении. Так, при температуре –183°С кислород конденсируется в прозрачную подвижную жидкость бледно- голубого цвета. Если жидкий кислород охладить еще сильнее, то при температуре –218°С кислород «замерзает» в виде синих кристаллов. Если температуру постепенно повышать, то при –218°С, твердый кислород начнет плавится, а при –183°С – закипит. Следовательно, температуры кипения и конденсации, а также температуры замерзания и плавления для веществ являются одинаковыми.
Для хранения и транспортировки жидкого кислорода используют так называемые сосуды Дьюара. Сосуды Дьюара используют для хранения и транспортировки жидкостей, температура которых должна длительное время оставаться постоянной. Сосуд Дьюара носит имя его изобретателя, шотландского физика и химика Джеймса Дьюара. Простейшим сосудом Дьюара является бытовой термос. Устройство сосуда довольно простое: это колба, помещенная в большую колбу. Из герметичного пространства между колбами откачивается воздух. Благодаря отсутствию воздуха между стенками колб, жидкость, налитая во внутреннюю колбу, долгое время не остывает или не нагревается.
Кислород — парамагнитное вещество, то есть в жидком и твердом состояниях он притягивается магнитом
В природе существует еще одно простое вещество, состоящее из атомов кислорода. Это озон. Химическая формула озона О3.
Озон, так же как и кислород, в обычных условиях – газ. Озон образуется в атмосфере во время грозовых разрядов. Характерный запах свежести после грозы является запахом озона. Если озон получить в лаборатории и собрать значительное количество его, то в больших концентрациях озон будет иметь резкий неприятный запах. Получают озон в лаборатории в специальных приборах – озонаторах.
Озонатор – это стеклянная трубка, в которую подают ток кислорода, и создают электрический разряд. Электрический разряд превращает кислород в озон: В отличие от бесцветного кислорода, озон – газ голубого цвета. Растворимость озона в воде составляет около 0,5 л газа на 1 литр воды, что значительно больше, чем у кислорода. С учетом этого свойства озон применяется для обеззараживания питьевой воды, так как оказывает губительное действие на болезнетворные микроорганизмы.
При низких температурах, озон ведет себя аналогично кислороду. При температуре –112°С он конденсируется в жидкость фиолетового цвета, а при температуре –197°С кристаллизуется в виде темно-фиолетовых, почти черных кристаллов Таким образом, можно сделать вывод, что атомы одного и того же химического элемента могут образовывать разные простые вещества.
Простые вещества, образованные одним и тем же элементом, называют аллотропными модификациями
Значит, кислород и озон – аллотропные модификации химического элемента кислорода. Существуют данные, что при сверхнизких температурах, в жидком или твердом состоянии кислород может существовать в виде молекул О4 и О8.






