Марганец взаимодействия и проблемы
Отравление марганцем возможно, хотя встречается редко. В большинстве случаев ежедневное употребление взрослыми людьми по 11 мг безопасно. Но в некоторых случаях у людей возможно не правильное вымывание марганца из организма, в результате может образовываться повышенное содержание марганца в организме.
Крайне маловероятен избыток марганца у взрослых при естественном питании. Скорее всего переизбыток марганца в организме возможен при приеме слишком большого количества определенных добавок. Например, пищевые добавки, пропагандируемые при остеоартрите, могут включать высокие уровни марганца в форме хондроитинсульфата и глюкозамина гидрохлорида. Это может привести к тому, что потребление человеком превысит допустимый верхний предел для взрослых — 11 мг марганца в день.
Люди, страдающие заболеванием печени, алкоголизмом или анемией перед приемом добавок с марганцем должны проконсультироваться с врачом. Марганец может накапливаться у этих людей и вызывать побочные действия. К симптомам избытка марганца в организме можно отнести психические проблемы, головокружение и дрожь, а также обострение заболеваний печени. При дефиците железа (анемия) также могут поглощать более высокие уровни марганца
Поэтому им следует проявлять осторожность в отношении дозировке потребления
Потребление марганца больше, чем 11 мг в день, может вызвать побочные эффекты, даже серьезные и очень опасные. Это неврологические расстройства, такие как болезнь Паркинсона. Всегда внимательно изучайте аннотацию на этикетке с добавками и следуйте инструкциям по дозировке. Прежде чем принимать марганец или любой другой минерал или питательное вещество, возможно проверить его уровень. Это необходимо, чтобы подтвердить, какое количество необходимо принимать в виде добавок.
Применение в промышленности
Применение в металлургии
Марганец в виде ферромарганца применяется для раскисления стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12—13 % Mn в сталь (так называемая сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (т. н. «наклёп»). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
В 1920—1940-х годах применение марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале «Сталь» возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определённого содержания марганца в процессе мартеновской плавки, в которой вместе с В. И. Явойским и В. И. Баптизманским принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Применение в химии
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением.
Теллурид марганца — перспективный термоэлектрический материал (термо-ЭДС 500 мкВ/К).
СВОЙСТВА
 Серебристо-белый цвет с легким серым налетом выделяет марганец. Он превосходит железо по твердости и хрупкости. Является парамагнетиком. При взаимодействии с воздушной средой происходит окисление марганца. Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Серебристо-белый цвет с легким серым налетом выделяет марганец. Он превосходит железо по твердости и хрупкости. Является парамагнетиком. При взаимодействии с воздушной средой происходит окисление марганца. Покрывается оксидной пленкой, защищающей его от последующей окислительной реакции.
Растворяется в воде, полностью поглощает водород, не вступая в реакцию с ним. В процессе нагревания сгорает в кислороде. Активно реагирует с хлором и серой. При взаимодействии с кислотными окислителями образует соли марганца.
Плотность — 7200 кг/м3, t плавления — 1247°С, t кипения — 2150 °С. Удельная теплоемкость — 0,478 кДж. Обладает электрической проводимостью. Контактируя с хлором, бромом и йодом образует дигалогениды.
При высоких температурах вступает во взаимодействие с азотом, фосфором, кремнием и бором. Медленно взаимодействует с холодной водой. В процессе нагревания реакционная способность элемента возрастает. На выходе образуется Mn(OH)2 и водород.
Избыток марганца
Передозировка этим полезным микроэлементом также возможна, но только не из пищи, т.к. получить отравляющую дозу марганца из еды фактически невозможно, быстрее живот треснет.
Важно! Симптоматика появляется при суточной дозировке нутриента в 40 мг!
Отравление марганцем сопровождается следующими симптомами:
- Нарушение в работе головного мозга – заторможенность, раздражительность, компульсии;
- Нарушение аппетита, тошнота, приступы рвоты;
- Развитие паркинсонизма;
- Развитие рахита.
Причины переизбытка Mn в организме
- Злоупотребление препаратами, в которых нутриент содержится, в т.ч. марганцовки, БАДов;
- Сварочные работы – вдыхание паров, в которых содержится вещество;
- Употребление отравленной простым веществом воды, главным образом, протекающей в местах марганцевых руд;
- Вдыхание загрязненного воздуха – проживание в промышленных регионах;
- Употребление наркотиков, в которых содержатся соли марганца.
Синтетические аналоги
 Самый известный марганецсодержащий фармпрепарат – это калия перманганат, KMnO4, или попросту, марганцовка. Правда, её используют лишь в качестве наружного антисептического средства для лечения ран, ожогов кожи, полосканий ротоглотки при простудных заболеваниях.
Самый известный марганецсодержащий фармпрепарат – это калия перманганат, KMnO4, или попросту, марганцовка. Правда, её используют лишь в качестве наружного антисептического средства для лечения ран, ожогов кожи, полосканий ротоглотки при простудных заболеваниях.
Иногда перманганат калия принимают как рвотное средство в ходе промываний желудка при некоторых отравлениях. Хотя использование препарата в таком качестве весьма спорно. Во-первых, очень трудно подобрать оптимальную концентрацию.
Концентрированная марганцовка может вызвать ожог слизистой полости рта, пищевода и желудка. А во-вторых, некоторая его часть при приеме внутрь всасывается, и можно получить отравление марганцем.
Что касается марганецсодержащих препаратов для приема внутрь в виде капсул и таблеток, то это не фармацевтические средства, а БАДы.

Здесь соединения марганца часто сочетаются с другими минералами и витаминнами. Эти препараты принимают как вспомогательные средства при иммунодефиците, остеопорозе, анемиях, психическом и физическом переутомлении, и других состояниях, связанных с повышенной потребности в марганце.
Причины и признаки дефицита
О дефиците марганца говорят в тех случаях, если его суточное поступление в организм взрослого человека составляет менее 1 мг. Основная причина – малое содержание в рационе натуральной пищи, содержащей микроэлемент, преобладание рафинированных продуктов или продуктов, содержащих большое количество синтетических ингредиентов.
Кроме того, при многих заболеваниях ЖКТ (желудочно-кишечного тракта) будет ухудшаться всасывание микроэлемент в тонком кишечнике. Этому же способствует прием препаратов, содержащих кальций и железо.
Дело в том, что эти два минерала ухудшают всасывание марганца. С возрастом всасывание ухудшается, и дефицит этого микроэлемента нередко наблюдается у лиц пожилого возраста.
Некоторые состояния сопровождаются усиленным расходом Mn:
- физические нагрузки (тяжелый труд, занятия спортом)
- умственные и психические нагрузки
- сахарный диабет
- хронические интоксикации на вредных производствах, проживание в экологически неблагоприятных регионах
- алкоголизм
- беременность
- период бурного роста
- «женские» заболевания с нарушением гормонпродуцирующей функцией яичников.
Сами по себе эти состояния не всегда приводят к марганцевому дефициту. Однако если они сочетаются между собой, а также с нерациональным питанием, заболеванием ЖКТ, то, скорее всего содержание его в организме будет снижено.
Признаки марганцевого дефицита неспецифичны, и во многом сходны с признаками дефицита других нутриентов. Отмечается общая слабость, ухудшение мыслительных функций, неустойчивость психики. Пациенты жалуются на головокружение, плохую координацию движений. Тонус мышц снижен, в отдельных случаях отмечаются мышечные судороги.
В костной ткани происходят изменения, аналогичные таковым при дефиците кальция. Снижается плотность костей, развивается остеопороз, возрастает риск переломов.
В суставах формируется артроз, обусловленный дегенерацией суставного хряща. Среди других патологических состояний, связанных с дефицитом марганца: анемия, атеросклероз, снижение иммунитета.
Возрастает риск сахарного диабета, сердечно-сосудистых и онкологических заболеваний, аллергических реакций с кожной сыпью, отеками и бронхоспазмом. Рано появляются признаки старения; дряблая морщинистая кожа с пигментными пятнами, выпадение волос, замедление роста ногтей. Из-за гормонального дисбаланса нередко возникает бесплодие.
У детей недостаточность чаще всего имеет пищевой характер, и часто сочетается с дефицитом других нутриентов. Такие дети отстают в психическом и физическом развитии. Они часто болеют инфекционными заболеваниями, страдают аллергиями. Иногда отмечается судорожный синдром.
Плюсы и минусы
Рассмотрим характеристики сплавов марганца.
| Достоинства | Недостатки |
| Химическая активность металла дает возможность получать множество соединений с различными свойствами | Высокая твердость в сочетании с хрупкостью ограничивает применение металла |
| Марганец образует сплавы практически со всеми металлами | Низкая электропроводность не позволяет использовать элемент в электротехнике |
| В сталелитейной промышленности сплавы с углеродом и кремнием незаменимы | Высокая температура кипения затрудняет работу с металлом |
| Соединения железа и марганца в любом соотношении образуют твердые растворы | Недостатки металла — следствие особенностей его структуры |
Трудно переоценить значение металла, как лигатуры.
Как составить меню, насыщенное марганцем
Источников Mn среди натуральных продуктов питания не так уж и мало. Поэтому даже при остром дефиците микровещества нетрудно составить меню из пищи, насыщенной полезным элементом. Желаете повысить концентрацию минерала в организме? Тогда рекомендации диетологов помогут правильно подобрать продукты для дневного рациона.
Примерное меню
Завтрак. Отличным вариантом для утренней трапезы послужит овсянка со свежей малиной. Оба продукта содержат в себе высокое количество марганца.
Обед. Приготовить сытный и вкусный обед, богатый марганцем, – не проблема, так как почти все овощи содержат в себе этот элемент. В качестве первого горячего блюда подойдет суп из зеленой фасоли или свекольник (свекла – богатейший Mn-источник). Этот нутриент содержится в ингредиентах большинства супов: в моркови, луке, чесноке и других. На второе в качестве гарнира приготовить рис (в идеале – коричневый) с говядиной и салат из листовых овощей с соевым соусом. Завершить трапезу десертом – свежим соком из клубники или винограда.
Ужин. На завершение дня можно побаловать себя витаминным шпинатом с гречкой, либо же овощным или фруктовым салатом. Перед сном выпить чашку чая из мяты или мелиссы.
На протяжении всего дня в качестве полезных перекусов подойдут разные виды орехов (миндаль, фундук, арахис, фисташки, кокос), фрукты и ягоды (инжир, киви, бананы, ананасы и все тропические фрукты, ежевика, клубника).
| Название продукта | Количество продукта | Количество марганца (мг) |
|---|---|---|
| Фундук | 200 г | 8,4 |
| Фисташки | 200 г | 7,6 |
| Арахис | 200 г | 3,82 |
| Соя | 200 г | 2,84 |
| Ячмень | 200 г | 2,39 |
| Пшеница | 200 г | 2,22 |
| Шпинат | 200 г | 1,82 |
| Свекольная ботва | 200 г | 1,48 |
| Ананас | 200 г | 1,46 |
| Грибы | 200 г | 1,22 |
| Мангольд | 200 г | 1,16 |
| Свекла | 200 г | 1,1 |
| Шиповник (сушеный) | 200 г | 1 |
| Картофель | 200 г | 0,76 |
| Брюссельская капуста | 200 г | 0,7 |
| Лук | 200 г | 0,64 |
| Брокколи | 200 г | 0,6 |
| Клубника | 200 г | 0,56 |
| Спаржа | 200 г | 0,56 |
| Капуста | 200 г | 0,54 |
| Абрикос | 200 г | 0,44 |
| Помидоры | 200 г | 0,42 |
| Морковь | 200 г | 0,34 |
| Цветная капуста | 200 г | 0,32 |
| Баклажан | 200 г | 0,22 |
| Сельдерей | 200 г | 0,2 |
| Огурец | 200 г | 0,16 |
| Коричневый рис | 1 стакан | 1,76 |
| Нут | 1 стакан | 1,69 |
| Чечевица | 1 стакан | 0,98 |
| Малина | 1 стакан | 0,82 |
| Зеленый горошек | 1 стакан | 0,72 |
| Гречка | 1 стакан | 0,68 |
| Черника | 1 стакан | 0,50 |
| Просо | 1 стакан | 0,47 |
| Зеленая фасоль | 1 стакан | 0,36 |
| Клюква | 1 стакан | 0,36 |
| Рожь | 0,5 стакана | 1,44 |
| Базилик | 0,5 стакана | 0,24 |
| Укроп | 0,5 стакана | 0,06 |
| Овес | 0,25 стакана | 1,92 |
| Семена тыквы | 0,25 стакана | 1,74 |
| Грецкие орехи | 0,25 стакана | 1,02 |
| Кунжут | 0,25 стакана | 0,89 |
| Семена подсолнечника | 0,25 стакана | 0,68 |
| Орехи кешью | 0,25 стакана | 0,66 |
| Миндаль | 0,25 стакана | 0,53 |
| Мята | 2 ст. л. | 0,9 |
| Соевый соус | 1 ст. л. | 0,09 |
| Гвоздика | 2 ч. л. | 2,53 |
| Корица | 2.ч. л. | 0,91 |
| Черный перец | 2 ч. л. | 0,74 |
| Чеснок | 6 зубчиков | 0,30 |
| Банан | 1 средний | 0,32 |
| Кукуруза | 1 кочан | 0,13 |
| Инжир | 1 средний | 0,06 |
ПРОИСХОЖДЕНИЕ

Вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Марганец (Mn, Manganum)
История марганца
Первооткрывателями марганца принято считать шведских химиков К. Шееле и Ю. Гана, первый из которых в 1774 году обнаружил неизвестный металл в широко используемой железной руде, называемой в древности чёрной магнезией, второй же путём нагревания смеси пиролюзита (основного минерала марганца) с углём получил металлический марганец (calorizator). Название новый металл получил от немецкого Manganerz, т.е. марганцевая руда.
Общая характеристика марганца
Марганец является элементом побочной подгруппы VII группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 25 и атомную массу 54,9380. Принятое обозначение – Mn (от латинского Manganum).
Нахождение в природе
Марганец достаточно распространён, входит во вторую десятку элементов по распространённости. В земной коре встречается чаще всего совместно с железными рудами, но имеются и месторождения именно марганца, например в Грузии и России.
Физические и химические свойства
Марганец является тяжёлым серебристо-белым металлом, так называемым чёрным металлом. При нагревании имеет свойство разлагать воду, вытесняя водород. В обычном состоянии поглощает водород.
Продукты питания богатые марганцем
Марганец попадает в организм человека с пищей, поэтому в обязательном порядке необходимо ежедневно съедать один или несколько продуктов из следующего списка:
- орехи (арахис, грецкий орех, миндаль, фисташки, фундук)
- крупы и злаки (пшено, гречка, овсянка, рис, рожь, пшеница)
- бобовые (горох, фасоль, чечевица)
- овощи и зелень (салат, листья свёклы, укроп, шпинат, чеснок)
- ягоды и фрукты (абрикосы, брусника, малина, черника, чёрная смородина)
- грибы (белые, подосиновики, лисички)
- говяжья печень.
Полезные свойства марганца и его влияние на организм
Функции марганца в организме человека:
- регуляция уровня глюкозы в крови, стимуляция выработки аскорбиновой кислоты
- профилактика сахара диабета путём снижения уровня сахара в крови
- нормализация мозговой деятельности и процессов в нервной системе
- участие в работе поджелудочной железы и синтезе холестерина
- способствование росту соединительных тканей, хрящей и костей
- влияние на липидный обмен и предотвращение избыточного отложения жира в печени
- участие в делении клеток
- снижение активности «плохого» холестерина и замедление роста холестериновых бляшек.
Взаимодействие с другими
Марганец помогает активизировать ферменты, необходимые для правильного использования организмом биотина, витаминов B1 и . Взаимодействие марганца с медью и цинком является признанным антиоксидантным средством. Большие дозы кальция и фосфора будут задерживать всасывание марганца.
Применение марганца в жизни
Наибольшее применение марганец нашёл в металлургии, также при производстве реостатов, гальванических элементов. Соединения марганца используют как термоэлектрический материал.
Признаки нехватки марганца
При режиме питания, утяжелённом большим количеством углеводов, в организме происходит перерасход марганца, что проявляется следующими симптомами: анемия, снижение прочности костей, задержка роста, а также атрофия яичников у женщин и яичек у мужчин.
Признаки избытка марганца
Излишек марганца также неполезен организму, его проявлениями могут служить сонливость, боли в мышцах, потеря аппетита и изменения в формировании костей – так называемый «марганцевый» рахит.
Нанобөлшектер
Басқа металдар сияқты, оның кристалдары немесе агрегаттары нанометриялық шкалалар сияқты кішкентай болуы мүмкін; Бұл болаттардан басқа қосымшаларға арналған марганец нанобөлшектері (NPs-Mn).
NPs-Mn метал марганеці араласуы мүмкін химиялық реакциялармен жұмыс жасағанда үлкен реактивтілікті қамтамасыз етеді. Өсімдік сығындыларын немесе микроорганизмдерді қолдана отырып, синтездеу әдісі жасыл болғанша, сіздің қоршаған ортаға деген ықтимал қосымшаларыңыз достық болады.
Оның кейбір қолданылуы:
-Таза сарқынды су
-Марганецтің қоректік қажеттіліктерін қамтамасыз ету
-Қызмет микробқа қарсы және саңырауқұлаққа қарсы агент ретінде
-Бояулар деградацияға ұшырайды
— Олар суперконденсаторлар мен литий-ионды батареялардың құрамына кіреді
-Олефиндердің эпоксидтелуін катализдеңіз
-ДНҚ сығындыларын тазартыңыз
Осы қосымшалардың ішінде олардың оксидтерінің нанобөлшектері (NPs MnO) қатыса алады немесе тіпті металдарды алмастыра алады.
Происхождение марганцевых руд
К марганцевым рудам относятся залежи полезных ископаемых, имеющих в своём составе от 10 до 70% искомого минерала, что является определяющим фактором экономической целесообразности их использования. Содержание серебристо-белого металла в земной коре не превышает 0,1%, причём сам он в свободном виде не встречается. Присутствует только в составе следующих химических видов руд:
- Оксидных. Они представлены в природе манганитовыми и псиломелано-пиролюзитовымизалежами неглубокого месторасположения, что и даёт возможность их окисления растворённым в воде кислородом. Содержание марганца в этих рудах 19-36%.
- Карбонатных.Олигонитовые, родохрозитовые, мангано-кальцитовые руды располагаются на значительных глубинах, где в отсутствие кислорода происходит их брожение и насыщение фосфором. Содержание в них марганца составляет 16-25%.
- Оксидно-карбонатных, представляющих собой смесь тех и других.
Происхождение или генезис марганцевых руд достаточно разнообразен, как и других полезных ископаемых. Природно-физические процессы привели к возникновению следующих типов марганцевых руд:
- Вулканогенных залежей, возникших в результате выброса магмы с последующей кристаллизацией.
- Руд, формирующихся в процессе выветривания, представляющего собой результат воздействия влаги, газов, перепадов температур, а также – биосферы.
- Метаморфизированных руд, пребывающих в толщах земной коры миллионы лет и при этом повергающихся усиленному давлению при высокой температуре.
- Осадочных пород. Массы ископаемых, расположенных ближе всего к земной поверхности, постоянно находящихся в процессе термодинамических воздействий.
- Донных залежей морей и океанов. Они представляют интерес в связи с огромными запасами, среди которых присутствуют марганцевые гидроксиды и целый ряд сопутствующих химических элементов.
Химиялық реакциялар
Марганец периодтық жүйедегі жақын көршілеріне қарағанда электрегативті емес, реактивті емес етеді. Алайда, ол оттегі болған кезде ауада жануы мүмкін:
3 Mn (s) + 2 O2 (g) => Mn3НЕМЕСЕ4 (-тер)
Ол азотпен шамамен 1200 ° C температурада реакцияға түсіп, марганец нитридін түзе алады:
3 Mn (s) + N2 (-тер) => Mn3N2
Ол тікелей бормен, көміртегімен, күкіртпен, кремниймен және фосформен үйлеседі; бірақ сутегімен емес.
Марганец қышқылдарда тез ериді, марганец ионымен тұз түзеді (Mn2+) және сутегі газын бөлу. Ол галогендермен бірдей әрекеттеседі, бірақ жоғары температураны қажет етеді:
Mn (s) + Br2 (g) => MnBr2 (-тер)
Валентности марганца
Элемент находится в седьмой группе. Типичные валентности марганца – II, III, IV, VI, VII.
Нулевая валентность типична для свободного вещества. Двухвалентные соединения — соли с катионом Mn2+, трехвалентные – оксид и гидроксид, четырехвалентные – двуокись, а также оксид-гидроксид. Шести- и семивалентные соединения — соли с анионами MnO42- и MnO4-.
Как получить и из чего получают марганец? Из марганцевых и железо-марганцевых руд, а также из растворов солей. Известно три разных способа получения марганца:
- восстановление коксом,
- алюмотермия,
- электролиз.
В первом случае в качестве восстановителя используется кокс, а также окись углерода. Восстанавливается металл из руды, где есть примесь оксидов железа. В результате получается как ферромарганец (сплав с железом), так и карбид (что такое карбид? это соединение металла с углеродом).
Для получения более чистого вещества используется один из способов металлотермии — алюмотермия. Сначала прокаливается пиролюзит, при этом получается Mn2O3. Затем полученный оксид смешивают с порошком алюминия. В ходе реакции выделяется много теплоты, в результате получающийся металл плавится, а оксид алюминия покрывает его шлаковой «шапкой».
Марганец — металл средней активности и стоит в ряду Бекетова левее водорода и правее алюминия. Это значит, что при электролизе водных растворов солей с катионом Mn2+ на катоде восстанавливается катион металла (при электролизе весьма разбавленного раствора на катоде восстанавливается и вода). При электролизе водного раствора MnCl2 протекают реакции:
MnCl2 Mn2+ + 2Cl-
Катод (отрицательно заряженный электрод): Mn2+ + 2e Mn0
Анод (положительно заряженный электрод): 2Cl- 2e 2Cl0 Cl2
Итоговое уравнение реакции:
MnCl2 (эл-з) Mn + Cl2
При электролизе получается наиболее чистый металлический марганец.
Справка для врачей
Марганец – это микроэлемент, который необходим для функционирования ферментов, участвующих в формировании костной и соединительной ткани, регуляции глюконеогенеза. Активно влияет на биосинтез холестерина, метаболизм инсулина, другие виды обмена веществ.
В большинстве случаев марганец не является структурным компонентом ферментов, но воздействует на их каталитическую активность.
Особое значение марганец имеет в поддержании функций половых желез, опорно-двигательного аппарата, нервной и иммунной систем.
Этот микроэлемент необходим для профилактики развития сахарного диабета, патологии щитовидной железы, недостаточности коронарных артерий сердца.
Избыток и передозировка
Фанатичное поедание человеком продуктов, богатых марганцем, провоцирует нарушение биохимического баланса организма.
Общее воздействие
Mn-передозировка опознается по следующим признакам:
- человек кушает даже любимые продукты без аппетита, просто потому, что надо;
- ему постоянно хочется спать;
- он отмечает явное ухудшение памяти;
- не отпускают судороги;
- время от времени ему «что-то кажется», то есть имеют место галлюцинации.
Сочетание подобных симптомов должно насторожить человека и стимулировать оперативно пересмотреть привычное меню.
Влияние на детский организм
Экстремальный переизбыток данного микроэлемента особо вреден для маленьких детей. Начинает прогрессировать марганцевый рахит. Его проявления аналогичны классическому варианту:
- башнеподобный череп;
- повышенная плаксивость, раздражительность;
- почти нулевой аппетит;
- на затылке выпадение волос и обильное потоотделение;
- вялые мышцы;
- впалость груди;
- искривление ножек.
Наблюдается отставание в развитии ребенка по нескольким параметрам:
- удерживание головки;
- прорезывание зубов;
- сидение, ползание;
- закрытие родничка.
Марганец тағамдары
Марганец — бұл ер адамның тамақтануында маңызды элемент, өйткені ол сүйек тінінің дамуына араласады; сонымен қатар оның түзілуінде және шеміршек түзетін протеогликандардың синтезінде.
Мұның бәрі үшін құрамында марганец бар, құрамында элементі бар тағамдарды таңдау керек.
Төменде марганец бар тағамдардың тізімі келтірілген, олардың мөлшері марганец / 100 г тағаммен көрсетілген:
-Анан 1,58 мг / 100г
— таңқурай мен құлпынай 0,71 мг / 100г
— Жаңа банан 0,27 мг / 100г
— 0,90 мг / 100г пісірілген шпинат
— тәтті картоп 0,45 мг / 100гр
-Соя бұршағы 0,5 мг / 100г
— 0,22 мг / 100г пісірілген қырыққабат
— қайнатылған брокколи 0,22 мг / 100г
-Бұршақ консервілері 0,54 м / 100г
-Пісірілген квиноа 0,61 мг / 100г
— Бидай ұны 4,0 мг / 100г
— Қалың күріш 0,85 мг / 100гр
-Барлық типтегі дәнді дақылдар 7,33 мг / 100г
-Чиа тұқымы 2,33 мг / 100г
-Қуырылған бадам 2,14 мг / 100г
Осы тағамдардың көмегімен ерлерде 2,3 мг / тәулікке есептелген марганецтің қажеттіліктерін қанағаттандыру оңай; ал әйелдерге күніне 1,8 мг марганец енгізу қажет.
Метаболизм
Всасывание поступившего внутрь Mn (II), осуществляется на всем протяжении тонкого кишечника. Характерно, что всасываемость небольшая, около 5%. Остальная часть выводится с калом. Всосавшийся марганец по воротной вене поступает в печень, где он находится в свободной форме или в связанной с плазменными белками глобулинами.
Определенное количество Mn (II) окисляется до Mn (III), и в комплексе с белком-переносчиком транспортируется в органы и ткани. Здесь его содержание может существенно различаться. Максимум микроэлемента в тканях органов, клетки которых содержат большое количество митохондрий. Это печень, поджелудочная железа, почки.
Миокард, мозговые структуры также содержат значительное количество марганца. Между тем, его уровень в плазме крови невелик, т.к. он довольно быстро транспортируется из крови в ткани. Выделяется преимущественно с калом, и в меньшей степени – с мочой. В кишечник он поступает в основном с желчью. При этом некоторая часть может обратно всасываться в кишечнике.
Кроме того, Mn из плазмы крови может секретироваться непосредственно в кишечник. При заболеваниях, сопровождающихся холестазом (застоем желчи) выделение марганца затрудняется. В этих случаях он секретируется в 12-перстную кишку с соком поджелудочной железы. Небольшое количество микроэлемента теряется с грудным молоком во время лактации.
Взаимодействие с другими веществами
Mn улучшает усваивание многих витаминов группы В, а также вит. Е и С. Он усиливает эффекты меди и цинка. Вместе с медью и железом марганец участвует в кроветворении. Однако в больших количествах он затрудняет всасывание железа. В свою очередь, железо ухудшает всасывание Mn. То же самое касается кальция, фосфора.
Из пищевых продуктов на содержание Mn негативно влияют сладости, кофеин, алкоголь. Они ухудшают его всасывание или увеличивают расход.
https://youtube.com/watch?v=VyXA_xn3RlE
Биологиялық рөл
Марганец көмірсулар, белоктар мен липидтер алмасуына, сонымен қатар сүйек түзуге және бос радикалдардан қорғану механизміне қатысады.
Марганец — көптеген ферменттердің белсенділігінің коакторы, соның ішінде: супероксид редуктаза, лигазалар, гидролазалар, киназалар және декарбоксилазалар. Марганецтің жетіспеушілігі салмақ жоғалтуға, жүрек айнуға, құсуға, дерматитке, өсудің тежелуіне және қаңқа ауытқуларына байланысты болды.
Марганец фотосинтезге қатысады, нақтырақ II фотосистема жұмысында, оттегі түзу үшін судың диссоциациялануымен байланысты. I және II фотосистемалар арасындағы өзара әрекеттесу АТФ синтезі үшін қажет.
Марганец азот көзі және өсімдіктердің негізгі қоректік компоненті өсімдіктерді нитратты бекіту үшін қажет деп саналады.
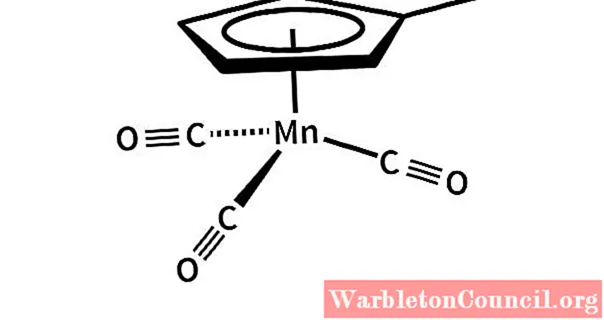
Органокомпозиттер
Марганец Mn-C көміртек атомдарымен байланыс түзе алады, бұл органомарганец деп аталатын бірқатар органикалық қосылыстардың пайда болуына мүмкіндік береді.
Органомарганецтегі өзара әрекеттесу не Mn-C немесе Mn-X байланыстарымен байланысты, мұндағы Х галоген, немесе хош иісті қосылыстар жүйесінің конъюгацияланған π жүйелерінің электрондық бұлттарымен марганецтің оң центрінің орналасуы.
Жоғарыда келтірілген мысалдарға фенилманганец иодид, PhMnI және метилциклопентадиенил марганец трикарбонил, (C5H4CH3) -Mn- (CO)3.
Бұл соңғы органомарганец CO-мен Mn-C байланыс түзеді, бірақ сонымен бірге С сақинасының хош иісті бұлтымен әрекеттеседі5H4CH3, ортасында сэндвич тәрізді құрылым түзеді:
Нехватка марганца — симптомы и причины
Симптомы нехватки марганца очень схожи с дефицитом прочих нутриентов, и могут выражаться в следующем:
- Ухудшение умственной функции, сонливость;
- Склонность к раздражению, агрессии, сильным переживаниям по незначительным ситуациям;
- Слабость, снижение силы в мышцах, а при тяжелом дефиците могут появиться мышечные судороги;
- Длительный дефицит приводит к снижению концентрации в организме кальция, развитию остепороза и склонностью к переломам;
- Нарушение функции кроветворения, анемии;
- Развитие атеросклероза, с дальнейшими нарушениями в работе сердечно-сосудистой системы в виде аритмий, перепадов артериального давления;
- Ухудшение здоровья кожи, ее дряблость, преждевременное появление морщин, а также склонность к аллергиям и кожной сыпи;
- Повышенное выпадение волос и ломкость ногтей;
- Снижется реактивность иммунной системы, что может вызывать частые простудные и прочие инфекционные болезни;
- Нарушение детородной функции у мужчин и женщин – ухудшение качества мужского семени и функции яичников у представительниц прекрасного пола;
- Риск развития онкологических болезней.
Симптомы нехватки Mn начинают появляться при его поступлении на уровне 1 мг в сутки и меньше в течение длительного времени.
Причины нехватки Mn
- Употребление некачественной пищи, т.е. продуктом, бедных на вместимость витаминов и макро-микроэлементов – фастфуды, полуфабрикаты, ГМО и прочее.
- Длительное голодание, жесткие диеты;
- Злоупотребление сладким и кофеинсодержащими напитками;
- Заболевания желудочно-кишечного тракта, при которых нарушено всасывание нутриентов – энтерит, дуоденит и прочие;
- Повышенные дозировки приема кальция и железа;
- Чрезмерные физические и умственные нагрузки, при которых за счет ускоренного кровообращения и метаболизма расход АТФ и различных элементов гораздо выше, нежели у гиподинамичного (малоподвижного) человека;
- Вредные привычки в виде курения и злоупотребления алкогольными напитками;
- Регулярная интоксикация организма различными отравляющими веществами – рыбота на вредном производстве, неблагоприятная экологическая обстановка в месте проживания, например, в центре города с повышенным транспортным трафиком;
- Пубертатный период, беременность;
- Женские болезни, сопровождающиеся дисфункцией яичников;
- Естественное старение организма, при котором многие вещества усваиваются хуже, нежели в молодом возрасте.
История открытия:
В чистом виде металл был получен в 1808 г. Джоном. Когда Шееле в 1774 г. занимался исследованием пиролюзита, он посылал своему другу Юхану Готлибу Гану образцы этого минерала. Ган, впоследствии профессор, выдающийся химик своего времени, скатывал из пиролюзита шарики, добавляя к руде масло, и сильно нагревал их в тигле, выложенном древесным углем. Получались металлические шарики, весившие втрое меньше, чем шарики из руды. Это и был марганец. Новый металл называли сначала «магнезия», но так как в то время уже была известна белая магнезия — окись магния, металл переименовали в «магнезиум»; это название и было принято Французской комиссией по номенклатуре в 1787 г.
Но в 1808 г. Хэмфри Дэви открыл магний и тоже назвал его «магнезиум», тогда во избежание путаницы марганец стали называть «манганум.»
Методы обогащения
Современные методы обогащения марганцевых руд основаны на разнице плотности, смачиваемости, магнитных характеристик разнообразных химических элементов. Благодаря ей удаётся произвести очистку руды от посторонних примесей.
Гравитационный
Гравитационные методы обогащения занимают ведущее место среди способов повышения концентрации полезного компонента в исходном материале – руде. Суть метода состоит в использовании неодинаковых физических характеристик. В данном случае – скоростей движения минеральных частиц в воздушной (пневматические процессы) или водной (гидравлические процессы) среде под воздействием гравитации или центробежных сил. Существуют специальные аппараты и технологии, позволяющие существенно увеличить содержание марганца в исходном сырье.
Гравитационно-магнитный
Добытая из месторождений руда из-за наличия в ней посторонних веществ непригодна к металлургическому переделу и требует обогащения. После обязательной промывки сырьё подвергается серии воздействий (гравитационных, магнитных, флотационных), последовательность и необходимость которых, определяется его размерами и химическим составом. Магнитная сепарация – это разделение материалов в неоднородном магнитном поле постоянного или переменного характера. Впервые изобретённая в конце XIX-го столетия, она стала основным методом обогащения железных и марганцевых руд. Так как, и те и другие обладают хорошими магнитными свойствами.
Флотация
Происходящий в жидкой среде под воздействием воздуха или с помощью добавления капель масла, процесс основан на смачиваемости жидкостью мелких частиц нужного вещества – марганца, и – несмачиваемости частиц посторонних примесей. На поверхности жидкости плавающая смесь воздуха, масла и минерала собирается, чтобы затем быть очищенной, высушенной и готовой для дальнейшего употребления в качестве концентрата.
Существуют и другие методы обогащения. В частности – рентгенометрическая сепарация. Впрочем, уровень современного состояния экономики позволяет разрабатывать индивидуальные технологии и оборудование, привязанное к конкретным залежам добываемого полезного ископаемого.






