Содержание
Фосфор — содержание в продуктах, бадах
Фосфор — макроэлемент, содержание которого вместе с кальцием очень важно для формирования костей и зубов, профилактики заболеваний сердечно-сосудистой системы, головного мозга, костей и суставов. Содержание фосфора в организме человека примерно 1% из них 85% содержатся в костях и зубах
Фосфор и его соединения принимают активное участие в окислительно-восстановительных реакциях организма, в процессах обмена протеинов и углеводов, жиров, нкоторых гормонов и ферментов.
Фосфор при соединении с кислородом образует фосфаты, являющиеся составной частью всех животных и растительных клеток.
Роль и значение фосфора для организма
- фосфор принимает участие в регуляции нервной системы;
- укрепляет костную ткань, десны, зубы;
- снижает боли при заболеваниях артритом;
- фосфор и кальций имеют тесную взаимосвязь в организме, которая частично регулируется гормонами, в частности, гормон околощитовидной железы уменьшает вторичную абсорбцию фосфата почками.
- фосфор взаимодействует со многими ферментами и активизирует действие витамина D и витаминов группы B;
- фосфор улучшает усвоение питательных веществ из пищи, участвует в передаче нервных импульсов, поддерживает низкий щелочной уровень крови.
Суточная потребность фосфора для детей
- Новорожденные 0 — 6 месяцев: 100 мг
- Младенцы 7 месяцев — 1 год: 275 мг
- Дети 1 — 3 года: 460 мг
- Дети 4 — 8 лет: 500 мг
- Дети 9 — 18 лет: 1250 мг
Суточная потребность фосфора для взрослых
- Взрослые от 19 лет и старше: 700 мг
- Беременные и кормящие грудью женщины моложе 18 лет: 1250 мг
- Беременные и кормящие грудью женщины от 19 лет и старше: 700 мг
При высоких физических нагрузках потребность в фосфоре увеличивается в 1,5-2 раза.
Лучшие источники органического фосфора
Коллоидные минералы, Хром Хелат, Ти Эн Ти (Полноценное здоровое питание на день), Супер Комплекс витаминов и минералов, Остео Плюс, Мега-Хел (комплекс витаминов и минералов), СмартМил Чай НСП.
Полноценное здоровое питание на день. Содержит макроэлемент Фосфор.
Топ 10 продуктов питания по содержанию фосфора
- Семечки (тыква и сквош), также богаты семечки подсолнечника, кунжута, арбуза
- Сыр «пекорино-романо», также большое содержание фосфора в следующих марках сыра: пармезан, козий сыр, моцарелла, грюйер, гауда
- Рыба (лосось), другая рыба с высоким содержанием фосфора: карп, сиг, трески, тунец и скумбрия
- Моллюски (гребешки), также много фосфора содержится в морских продуктах: креветках, мидиях, крабах
- Бразильский орех, а также кедровые орешки, миндаль и кешью, и фисташки
- Свинина (постное филе)
- Говядина и телятина (постная говядина)
- Молоко (нежирное)
- Соевый продукт (тофу)
- Бобы и чечевица, также высокое содержание фосфора содержат бобовые: фасоль адзука, желтые бобы, черная фасоль, белая фасоль
Взаимодействие фосфора
Усвоение фосфора понижается при приеме большого количества магния, алюминия и железа, а также витамина A, Д, F и ряда ферментов и белков.
Усвоение фосфора происходит эффективнее при его приеме вместе с кальцием в соотношении 1,5:1 (P:Ca).
Симптомы дефицита фосфора в организме
- боли в костях и суставах;
- болезни костей;
- истощение нервной системы;
- психические заболевания;
- дистрофические изменения миокарда;
- ослабление иммунитета, частые простуды;
- общая слабость, повышенная утомляемость, потеря аппетита.
Симптомы переизбытка фосфора в организме
Примите во внимание, что излишнее количество фосфора в организме, которое может быть вызвано длительным контактом с соединениями фосфора, потреблением сладкой газированной воды и консервов, вытесняет из организма кальций, что приводит к развитию жировой дистрофии печени, кожным заболеваниям, мочекаменная болезни
Осторожно относитесь к продуктам, в которых в качестве консервантов используются фосфаты, учитывайте их как часть вашего потребления фосфора
Осторожно относитесь к продуктам, в которых в качестве консервантов используются фосфаты, учитывайте их как часть вашего потребления фосфора
Недостаток фосфора
Типичные причины развития дефицита микроэлемента в организме:
- Голодание.
- Пищевые отравления.
- Нарушение обмена веществ из-за дисфункции почечных канальцев и околощитовидных желез, сахарного диабета, алкоголизма.
- Беременность, кормление грудью, фаза роста, повышенная физическая нагрузка.
- Недостаточное поступление микроэлемента с продуктами питания. Дефицит вещества зачастую наблюдается у лиц, питающихся растительной пищей, которая росла в почве с низким содержанием соединений фосфора.
- Злоупотребление газированными напитками.
- Поступление в организм кальция, бария, магния, алюминия. Ионы данных металлов вступая в реакцию с фосфором образуют нерастворимые соединения, которые выводят микроэлемент Р из обмена веществ.
- Хронические заболевания почек.
- Искусственное вскармливание.
Симптомы нехватки фосфора в организме:
- ослабление иммунитета и частые простудные заболевания;
- пародонтоз, рахит;
- геморрагические высыпания на кожных покровах и слизистых поверхностях;
- истощение, отсутствие аппетита;
- ожирение печени;
- психические заболевания;
- слабость, ощущение разбитости;
- слабая концентрация внимания;
- боли в мышечной, костной тканях, суставах;
- дистрофические изменения миокарда;
- нарушения памяти;
- неритмичное дыхание;
- тревога, чувство страха;
- изменения в весе;
- онемение или повышенная чувствительность кожи;
- раздражительность, депрессия.
Восполнить дефицит микроэлемента лучше при помощи продуктов питания или пищевых добавок. Хроническая фосфорная недостаточность устраняется по средством введения в организм больного следующих лекарственных препаратов: АТФ, фитина, фосфоколина, рибоксина, фосфрена, лецитина, натрия фосфата или фитоферролактола.
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Ca3(PO4)2·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Суточная потребность в фосфоре составляет:
- для взрослых 1,0—2,0 г
- для беременных и кормящих женщин 3—3,8 г
- для детей и подростков 1,5—2,5 г
При больших физических нагрузках потребность в фосфоре возрастает в 1,5—2 раза.
Усвоение происходит эффективнее при приёме фосфора вместе с кальцием в соотношении 3:2 (P:Ca).
| Продукт | Содержание, мг/100 г |
|---|---|
| Очищенное конопляное семя | 1650 |
| Семена тыквы (ядра) | 1233 |
| Семена подсолнечника (ядра) поджаренные | 1158 |
| Семена мака | 870 |
| Горчичный порошок | 828 |
| Кунжут (очищенный) | 774 |
| Семена дыни (ядра) | 755 |
| Какао-порошок | 734 |
| Твёрдый пармезан | 694 |
| Семена подсолнечника (ядра) сушёные | 660 |
| Сафлора семена (ядра) | 644 |
| Семена льна | 642 |
| Семена лотоса | 626 |
| Сыр швейцарский нежирный | 605 |
| Кешью сырые | 593 |
| Орехи пили | 575 |
| Амарантовая крупа | 557 |
| Сыр гауда | 546 |
| Овёс | 523 |
| Грецкий орех чёрный | 513 |
| Печень говяжья тушёная | 497 |
| Фисташки сырые | 490 |
| Миндаль | 481 |
| Киноа | 457 |
| Люпин, семена | 440 |
| Карп | 415 |
| Фасоль | 407 |
| Арахис | 397 |
| Сыр рокфор | 392 |
| Мука из цельного зерна | 357 |
| Печень куриная | 297 |
| Вырезка свиная | 286 |
| Желтоперый тунец | 278 |
| Сгущённое молоко | 253 |
| Яйцо | 198 |
| Говядина | 188 |
| Курица | 178 |
Токсикология элементарного фосфора
- Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
- Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2—3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать поражённые участки растворами медного купороса или соды. ПДК паров фосфора в воздухе производственных помещений — 0,03 мг/м³, временно допустимая концентрация в атмосферном воздухе — 0,0005 мг/м³, ПДК в питьевой воде — 0,0001 мг/дм³.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Ввиду высокой (ЛД50 15-100 мг/кг) и чрезвычайно высокой (<15 мг/кг) токсичности большинство фосфорорганических соединений (ФОС) используются в качестве пестицидов (инсектициды, акарициды, зооциды и т. д.) или боевых отравляющих веществ. Примером боевых отравляющих веществ являются — зарин, зоман, табун, новичок, V-газы.
ФОС проявляют свойства веществ нервно-паралитического действия. Токсичность фосфорорганических соединений обусловлена ингибированием фермента ацетилхолинэстеразы, вследствие чего развивается головная боль, тошнота, головокружение, сужение зрачков (миоз), затруднение дыхания (отдышка), возникает слюнотечение, понижается артериальное давление, возникают конвульсии, проявляется паралитическое воздействие, кома, и как следствие может быстро возникнуть летальный исход. Эффективным антидотом при отравлении ФОС является атропин.
Свойства фосфора (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Фосфор |
| 102 | Прежнее название | |
| 103 | Латинское название | Phosphorus |
| 104 | Английское название | Phosphorus |
| 105 | Символ | P |
| 106 | Атомный номер (номер в таблице) | 15 |
| 107 | Тип | Неметалл |
| 108 | Группа | Пниктоген |
| 109 | Открыт | Хенниг Бранд, Германия, 1669 г. |
| 110 | Год открытия | 1669 г. |
| 111 | Внешний вид и пр. | Твёрдое вещество белого, красного, фиолетового, черного или синего цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | Несколько аллотропных модификаций фосфора, в т.ч.:
– белый фосфор (α-фосфор (α-форма) с кубической объёмно-центрированной кристаллической решёткой и β-фосфор (β-форма) с гексагональной кристаллической решёткой), – красный фосфор, – фиолетовый фосфор, – чёрный фосфор, – синий фосфор |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | Фосфорен |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,099 % |
| 120 | Содержание в морях и океанах (по массе) | 7,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0007 % |
| 122 | Содержание в Солнце (по массе) | 0,0007 % |
| 123 | Содержание в метеоритах (по массе) | 0,11 % |
| 124 | Содержание в организме человека (по массе) | 1,1 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 30,973762(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p3 |
| 203 | Электронная оболочка |
K2 L8 M5 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 98 пм |
| 205 | Эмпирический радиус атома* | 100 пм |
| 206 | Ковалентный радиус* | 107 пм |
| 207 | Радиус иона (кристаллический) | P3+
58 (6) пм, P5+ 52 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 180 пм |
| 209 | Электроны, Протоны, Нейтроны | 15 электронов, 15 протонов, 16 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 15-ая группа (по старой классификации – главная подгруппа 5-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3 , -2, -1, 0, +1, +2, +3 , +4, +5 |
| 302 | Валентность | III, V |
| 303 | Электроотрицательность | 2,19 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1011,81 кДж/моль (10,486 686 (15) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | 42 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 1,823 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – белый фосфор,
≈2,2-2,34г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – красный фосфор, 2,36 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – фиолетовый фосфор, 2,69 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) – чёрный фосфор |
| 402 | Температура плавления | 44,15 °C (317,3 K, 111,5 °F) – белый фосфор,
≈590 °C (≈860 K, ≈1090 °F) – красный фосфор |
| 403 | Температура кипения | 280,5 °C (553,7 K , 536,9 °F) – белый фосфор |
| 404 | Температура сублимации | ≈416-590 °C (≈689,2-863 K, ≈780,8-1094 °F) – красный фосфор,
620 °C (893 K, 1148 °F) – фиолетовый фосфор |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,66 кДж/моль – белый фосфор |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 51,9 кДж/моль – белый фосфор |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 23,824 Дж/(K·моль) – белый фосфор |
| 411 | Молярный объём | 17,0 см³/моль |
| 412 | Теплопроводность | 0,236 Вт/(м·К) (при стандартных условиях) – белый фосфор,
12,1 Вт/(м·К) (при стандартных условиях) – красный фосфор, 0,236 Вт/(м·К) (при 300 K) – белый фосфор |
| 500 | Кристаллическая решётка | |
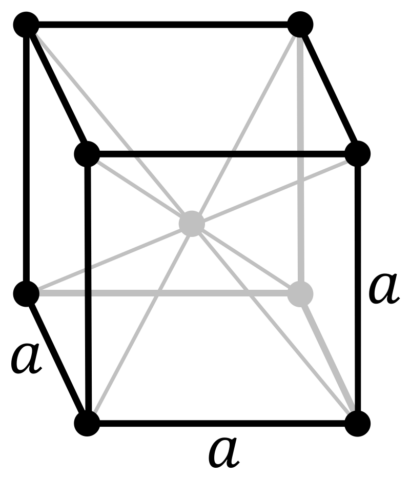
| 511 | Кристаллическая решётка #1 | Белый фосфор α-форма |
| 512 | Структура решётки |
Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 18,800 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | P-1 |
| 517 | Номер пространственной группы симметрии | 2 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 12185-10-3 – белый фосфор,
7723-14-0 – красный фосфор |
Примечание:
205* Эмпирический радиус атома фосфора согласно составляет 128 пм.
206* Ковалентный радиус фосфора согласно и составляет 107±3 пм и 106 пм соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) белого фосфора согласно составляет 2,51 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) белого фосфора согласно составляет 49,8 кДж/моль.
Важнейшие соединения:
Оксид фосфора(V), P2O5 или фосфорный ангидрид — белое кристаллическое вещество. Реальный состав молекулы оксида фосфора (V) соответствует формуле P4O10. Фосфорный ангидрид жадно поглощает воду, при этом в зависимости от соотношения числа молекул воды и оксида фосфора (V) P2O5 образуется несколько типов фосфорных кислот: мета- и ортофосфорная, дифосфорная, а также большая группа полифосфорных кислот. Сила полифосфорных кислот возрастает с увеличением числа атомов фосфора.
При взаимодействии P2O5 с водой при обычных условиях получается метафосфорная кислота НРO3:
P4O10 + 2H2O = 4НРO3
а при нагревании водного раствора метафосфорной кислоты образуется ортофосфорная кислота H3PO4:
НРO3 + H2O = H3PO4Оксид фосфора(III), P2O3 — бесцветное, кристаллическое, очень ядовитое вещество с неприятным запахом, Тпл 23,8° С. По аналогии с оксидом фосфора (V) образует молекулы P4O6. С водой образует фосфористые кислоты. Ортофосфористая кислота, H3PO3 — слабая двухосновная кислота, сильный восстановитель. Ее особенность — только два атома водорода способны замещаться на металл, соли называются фосфитами. При нагревании ее в водном растворе выделяется водород:
H3PO3 + H2O = H3PO4 + H2Фосфиновая кислота,
(устар. фосфорноватистая) H3PO2, бесцветные кристаллы, расплывающиеся на воздухе и хорошо растворимые в воде, Тпл 26,5° С. В промышленности получается при кипячении белого фосфора с водной суспензией шлама Ca(OH)2 или Ba(OH)2. Образовавшийся гипофосфит кальция обрабатывают сульфатом натрия или раствором серной кислоты с целью получения гипофосфита натрия или свободной кислоты.Трихлорид фосфора, PCl3 — жидкость с резким неприятным запахом, дымящая на воздухе. Ткип 75,3° С, Тпл -40,5° С. В промышленности его получают пропусканием сухого хлора через суспензию красного фосфора в PCl3.Пентахлорид фосфора,
PCl5 — светло-желтое с зеленоватым оттенком кристаллическое вещество с неприятным запахом. Кристаллы имеют ионное строение [PCl4+][PCl6-]. Твозг 159° С. Получается при взаимодействии PCl3 с хлором или S2Cl2:
3PCl3 + S2Cl2 = PCl5 + 2PSCl3.Водородные соединения: фосфористый водород РН3 (фосфин) бесцветный газ с характерным запахом чеснока, обычно в качестве примеси он содержит следы более активного дифосфина (P2H4) и поэтому самовоспламеняется на воздухе при комнатной температуре. Получение:
4Р + 3КОН + 3Н2O = РН3 + 3КН2РO2
При этом способе получения кроме газообразного фосфористого водорода образуется также жидкий фосфористый водород, газообразный водород и кислый гипофосфит калия по уравнениям:
6Р+4КОН + 4Н2O = Р2Н4 + 4КН2РO2
2Р + 2КОН + 2Н2O = Н2 + 2КН2РO2
Соединения фосфора
Фосфин РН3. Бинарное соединение, степень окисления фосфора равна — III. Бесцветный газ с неприятным запахом. Молекула имеет строение незавершенного тетраэдра [: Р(Н)3] (sр3-гибридизация). Мало растворим в воде, не реагирует с ней (в отличие от NH3). Сильный восстановитель, сгорает на воздухе, окисляется в HNО3 (конц.). Присоединяет HI. Применяется для синтеза фосфорорганических соединений. Сильно ядовит.
Уравнения важнейших реакций фосфина:
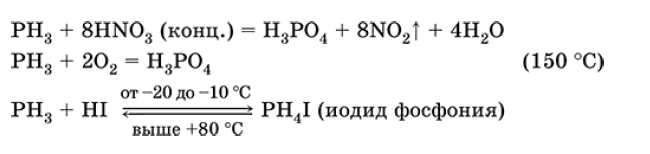
Получение фосфина в лаборатории:
СазP2 + 6НСl (разб.) = ЗСаСl + 2РНз
Оксид фосфора (V) P2O5. Кислотный оксид. Белый, термически устойчивый. В твердом и газообразном состояниях димер Р4О10 со строением из четырех тетраэдров [O=Р(O)3], связанных по трем вершинам (Р — О-P). При очень высоких температурах мономеризуется до P2O5. Существует также стеклообразный полимер (Р205)п. Чрезвычайно гигроскопичен, энергично реагирует с водой, щелочами. Восстанавливается белым фосфором. Отнимает воду у кислородсодержащих кислот.
Применяется как весьма эффективный дегидратирующий агент для осушения твердых веществ, жидкостей и газовых смесей, реагент в производстве фосфатных стекол, катализатор полимеризации алкенов. Ядовит.
Уравнения важнейших реакций оксида фосфора +5:
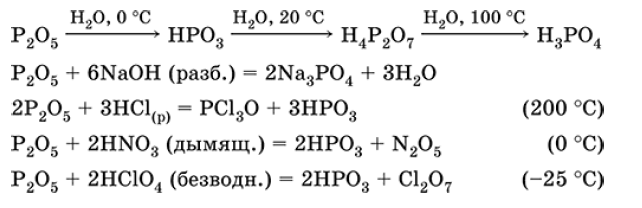
Получение: сжигание фосфора в избытке сухого воздуха.
Ортофосфорная кислота Н3Р04. Оксокислота. Белое вещество, гигроскопичное, конечный продукт взаимодействия P2O5 с водой. Молекула имеет строение искаженного тетраэдра [Р(O)(OН)3] (sр3-гибридизадия), содержит ковалентные σ-связи Р — ОН и σ, π-связь Р=O. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворяется в воде (548 г/100 г Н20). Слабая кислота в растворе, нейтрализуется щелочами, не полностью — гидратом аммиака. Реагирует с типичными металлами. Вступает в реакции ионного обмена.
Качественная реакция — выпадение желтого осадка ортофосфата серебра (I). Применяется в производстве минеральных удобрений, для осветления сахарозы, как катализатор в органическом синтезе, компонент антикоррозионных покрытий на чугуне и стали.
Уравнения важнейших реакций ортофосфорной кислоты:

Получение фосфорной кислоты в промышленности:
кипячение фосфоритной руды в серной кислоте:
Ca3(PO4)2 + 3H2SO4 (конц.) = 2Н3РО4 + 3CaSO4
Ортофосфат натрия Na3PO4. Оксосоль. Белый, гигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. Реагируется в растворе с цинком и алюминием.
Вступает в реакции ионного обмена.
Продукты, содержащие фосфор
Фосфор содержится почти во всех продуктах. Но больше всего его содержится в мясе, рыбе, морепродуктах, птице, яйцах, молочной продукции. Большое количество фосфора содержится в сухих дрожжах. На 100 г продукта приходится 1290 мл фосфора. Примерно столько же его содержится в отрубях, тыквенных семечках.
При составлении своего рациона нелбходимо правильно подбирать продукты и учитывать не только содержание в продуктах фосфора, но и кальция. Оптимальное соотношение поступления в организм кальция и фосфора – 2:1. Нарушение этих пропорций приводит к дефициту или переизбытку кальция или фосфора в организме.
Хорошим вариантом будет включение в ежедневный рацион свеклы, моркови, капусты, фундука, творога, говяжьей печени, овсяной, гречневой, пшеничной каши, грецких орехов, фасоли.
- Зерновые культуры. Много фосфора содержится в пшеничной, овсяной, кукурузной, ячменной крупах. Сконцентрирован он в оболочке, поэтому для приготовления блюд покупать лучше необработанные. Лидером среди них является кукуруза. В стакане кукурузной муки содержится 850 мг фосфора;
- Брокколи. В 100 г капусты содержится 66 мг полезного микроэлемента. Кроме этого, она богата железом, кальцием, калием, цинком и плюс к этому – малокалорийная. При ее приготовлении самое главное – не подвергать ее долгой термической обработке;
- Орехи, семечки. Самыми полезными считаются кедровые, грецкие орехи, фисташки. Всего 70 г орехов достаточно для восполнения 40% требуемого объема фосфора в сутки. Богаты фосфором семена подсолнечника, кунжута, чиа, тыквы. Так, 100 г семян тыквы полностью покрывают его дневную норму;
- Морепродукты и морская рыба. Наличие в рационе морепродуктов способствует улучшению работы сердечно-сосудистой системы. Кроме фосфора, они богаты йодом, витаминами, цинком, ценнейшими кислотами Омега-3, так необходимыми для нормального функционирования организма;
- Молочные продукты. Лидерами по содержанию фосфора являются творог, молоко, йогурт;
- Мясо птицы. Мясо курицы, индейки является прекрасным источником фосфора. Кроме этого, в нем содержится много белка, витамина В, селена;
- Бобовые. Больше фосфора содержится в белой фасоли, в красной чуть меньше. Особенно они ценятся за высокое содержание клетчатки;
- Арахисовая паста. В арахисовой пасте также присутствует этот полезный микроэлемент. Наиболее полезна та, где отсутствуют загустители и подсластители.
Физические свойства:
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропных модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белую, красную (см. рис.), черную и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропных модификации фосфора. Белый фосфор, фосфор в жидком и растворенном состоянии, а также в парах до 800°С состоит из молекул P4. При нагревании выше 800 °С молекулы диссоциируют: P4 = 2P2. При температуре выше 2000°С молекулы распадаются на атомы.Красный фосфор
имеет формулу (Р4)n и представляет собой полимер со сложной структурой, имеет оттенки от пурпурно-красного до фиолетового, растворим в расплавленных металлах (Bi, Pb).Чёрный фосфор
— это наиболее стабильная форма, вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, нерастворимое в воде или органических растворителях, полупроводник.
Очистка, доочистка, удаление фосфатов
Физико-химические способы
Как и со многими другими загрязняющими сточными воды веществами, для очистки вод от фосфатов применяются физико-химические методы. Сточную воду подвергают фильтрованию с целью удаления взвешенных веществ. Благодаря этому из воды удаляют часть фосфатных соединений. Затем в воду, подвергаемую очистке, вводятся коагулянты на основе сульфата алюминия, оксихлорида алюминия или хлорида железа, иногда совместно с флокулянтом – полиакриламидом. Это помогает образованию коллоидных фосфатов, их совместному осаждению с коагулянтами. Потом, вода с уже осаждёнными фосфатами подвергается отстаиванию или очистке флотацией. На этом этапе удаляется до 90% фосфатов. Источником коагулянтов могут служить специальные железные или алюминиевые аноды. В случае электрохимической очистки процесс происходит быстрее, поскольку выделяющиеся при электролизе газы помогают хлопьям оксидов и гидроксидов металлов подыматься на поверхность воды, где они удаляются. Однако, этот метод дорогой в эксплуатации, из-за чего его редко используют.
Биологические способы
Биологическим методом очистки сточной воды называется использование активного ила, содержащего в себе ряд аэробных и анаэробных микроорганизмов, способных использовать загрязняющие фосфаты в своём метаболизме. Как правило, при биологической очистке идёт процесс одновременного удаления из сточных вод фосфора и азота, поскольку оба этих элемента играют важную роль в процессах обмена веществ живых организмов.
Специфика метода заключается во введении в специальных резервуарах (аэротенках и метантенках) в сточные воды активного ила и питательного субстрата для него. Питательный субстрат необходим для создания оптимальных условий для тех бактерий, которые активно участвуют в процессе дефосфоризации. В качестве этого субстрата часто используют низкомолекулярные летучие жирные кислоты, а основной питательной средой выступают уксусная и пропионовая кислоты. В процессе бескислородного потребления бактериями органических кислот полифосфаты начинают разлагаться (до фосфатов). Бактерии используют энергию распада этих соединений в качестве топлива для поддержания процессов жизнедеятельности. Затем уже в аэробных условиях начинается размножение бактерий и водорослей, во время которого свободные фосфаты используются для синтеза АТФ бактериями. Таким образом, фосфаты из воды попадают в биомассу, которая затем отделяется от уже очищенной воды.
Комбинированные
Комбинированным методом очистки сточных вод называется процесс, в котором после химической коагуляции, вода подвергается дополнительно процессу биологической очистки. Использование комбинированного метода весьма выгодно, поскольку происходит более полная и тщательная очистка воды. Однако, существуют нюансы.
Например, введение коагулянтов и извести в фильтруемую воду достаточно сильно повышает показатель рН воды, что губительно для микроорганизмов. Чтобы бороться с этим явлением, воду подвергают карбонизации – насыщают её углекислым газом. Углекислый газ, проходя сквозь воду, образует угольную кислоту, которая помогает снизить рН до допустимых значений.
После прохождения двух этапов очистки, вода фильтруется, из неё удаляются нерастворимые осадки, активный ил, проводится её исследование на соответствие требованиям. После этого очищенная вода отправляется в сброс.
[править] История открытия
Открытие фосфора
Фосфор открыл гамбургский алхимик Хенниг Бранд в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать эликсир жизни или философский камень, а получил вещество, которое светится. Этим открытием Бранд не обогатился и продал способ получения Даниэлю Крафту (Johann Daniel Kraft), заработавшему на этом состояние. Чуть позже фосфор получил другой немецкий химик — Иоганн Кункель. Независимо от Бранда и Кункеля фосфор получил Роберт Бойль, который описал его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году. Усовершенствованный способ получения фосфора был опубликован Андреасом Маргграфом через 50 лет. Существуют данные, что фосфор умели получать арабские алхимики в XII веке.
Действие фосфора, его функции и роль в организме человека
Теперь давайте ответим на вопрос, какая роль фосфора в организме человека. А она очень большая, так как фосфор принимает участие во всех обменных процессах, происходящих в нашем организме. Основная масса фосфора находится в костях и зубах. Совместно с кальцием фосфор формирует правильную структуру костной ткани, и если пропорция содержания кальция и фосфора будет нарушена, то кости могут стать хрупкими, увеличится риск переломов.
Помимо костей и зубов фосфор имеет влияние и на самое главное – мыслительное деятельность человека, ведь он содержится в нашей мозговой ткани и нервах. От фосфора зависит работа нервной системы, с его помощью осуществляется метаболизм липидов и протеинов, биосинтез всех необходимых органических веществ. Наконец фосфор входит в состав ДНК и РНК, участвует в ферментивных процессах, поддерживающих кислотно-щелочной баланс в организме.
[править] Химические свойства
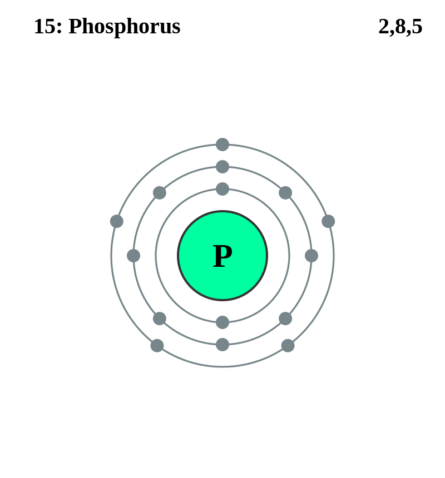
Фосфор относится к пятой группе третьего периода периодической системы элементов. Порядковый номер 15. Имея на внешней электронной оболочке пять электронов: (15 = 2 + 8 + 5), атомы фосфора имеют свойства окислителя и, присоединяя от атомов других элементов три электрона, недостающие для заполнения внешней оболочки, превращаются в отрицательно трехвалентные ионы. Фосфор менее активный окислитель, чем азот, поскольку его валентные электроны находятся дальше от ядра атома и слабее с ним связаны, чем валентные электроны атомов азота.
Атомы фосфора могут также терять свои валентные электроны, превращаясь при этом в положительно заряженные ионы. В связи с большим удаленностью валентных электронов от ядра атома фосфор гораздо легче отдает эти электроны, чем азот. Поэтому металлические свойства фосфора проявляются более отчетливо, чем у азота.
С кислородом фосфор соединяется довольно энергично, особенно белый, выделяя значительное количество тепла и образуя оксид фосфора (V):
4P + 5O2 = 2P2O5
Фосфор довольно легко реагирует и с другими неметаллами, особенно с хлором, с которым он даже при небольшом нагревании энергично взаимодействует с образованием бесцветных кристаллов пентахлорида фосфора PCl5:
2P + 5Cl2 = 2PCl5
При очень высокой температуре фосфор, подобно азоту, может соединяться со многими металлами, образуя фосфиды:
2P + 3Ca = Ca3P2
С водородом фосфор непосредственно не взаимодействует. Но посредственным путем можно получить соединения фосфора с водородом. Например, при воздействии на фосфид кальция разведенной соляной кислоты образуется фосфин PH3, который по своим свойствам напоминает аммиак: