Физиологическая потребность в Магнии, мг в сутки:
| Пол | Грудной | Преддошкольный | |||
| 0-3 мес | 4-6 мес | 7-12 мес | 1-2 года | 2-3 года | |
| Мужской | 55 | 60 | 70 | 80 | |
| Женский |
| Пол | Дошкольный | Младший | Средний | Подростковый |
| 3-7 лет | 7-11 лет | 11-14 лет | 14-18 лет | |
| Мужской | 200 | 250 | 300 | 400 |
| Женский |
| Пол | Взрослые | Пожилые | Беременные(2-ая половина) | Кормящие |
| 18-29 лет | 30-39 лет | 40-59 лет | старше 60 | |
| Мужской | 400 | — | ||
| Женский | дополн. +50 |
Верхний допустимый уровень потребления Магния не установлен.
Потребность возрастает при:
- стрессе
- содержании в рационе большого количества белка
- быстром формировании новых тканей — у детей, бодибилдеров
- беременности 2 и кормлении грудью
- приеме мочегонных средств
Химические свойства:
Отношение к воздуху и кислороду при обычных условиях: …
При нагревании: …
С холодной водой магний почти не взаимодействует, но при нагревании разлагает ее с выделением водорода. В этом отношении он занимает промежуточное положение между бериллием, который вообще с водой не реагирует и кальцием, легко с ней взаимодействующим.
В электрохимическом ряду напряжений магний стоит значительно левее водорода и активно реагирует с разбавленными кислотами с образованием солей. В этих реакциях есть у магния особенности. Он не растворяется во фтороводородной, концентрированной серной и в смеси серной и в смеси азотной кислот, растворяющей другие металлы почти столь же эффективно, как «царская водка» (смесь HCl и HNO3). Не взаимодействует с растворами щелочей.
Применение MgO в промышленности
Благодаря высокой температуре плавления, магний оксид используется в строительстве. В этом случае высоко ценится так называемый «каустический магнезит», который получают путем обжига природного магнезита. Особенно широкое применение он получил при создании строительных материалов таких, как ксилит, цемент, бетон. Химическое вещество повышает их огнеупорность, поэтому такие материалы часто применяют при строительстве производственных помещений, жилых и общественных.
Также вещество MgO используют для создания вяжущих веществ. Однако его свойство впитывать влагу позволяет применять такие материалы и смеси только для строительства помещений с преимущественно сухим режимом эксплуатации. В автомобильной промышленности это химическое соединение вводят в резиновые смеси, а также для вулканизации в качестве активатора других ускорителей.
Легкая окись магния обладает абразивными свойствами, поэтому ее часто используют в электронной промышленности для очистки «чувствительных» поверхностей. Помимо этого жженая магнезия нашла свое применение в таких случаях:
- входит в состав защитного слоя в жидкокристаллических экранах;
- применяется в производстве бумаги;
- включается в состав нагревательных элементов в системах отопления;
- некоторые виды нефтепродуктов очищаются с помощью этого химического соединения.
Еще одно важное свойство соединения MgO состоит в том, что с его помощью можно контролировать процесс растворяемости радионуклидов. Это качество очень полезно на заводах, перерабатывающих отходы, применение жженной магнезии в этом случае для сохранения экологического равновесия
Перспективным сегментом потребления оксида магния сегодня считается сельское хозяйство. Здесь с его помощью предотвращают слеживание удобрений и применяют как самостоятельную добавку для обогащения почвы магнием
Недостаток магния на сельхозугодьях отражается на производимой продукции, поэтому применение такого удобрения очень важно для урожая. Правда чаще всего еще используют сульфат магния, так как последний немного дешевле жженной магнезии
Также свое применение это вещество нашло в животноводстве. Дефицит магния сказывается на здоровье скота и продуктах, получаемых от них. Обычно питание животных на фермах содержит достаточно всех необходимых минералов и витаминов. Но на пастбищах, удобренных калием и азотом иногда бывает недостаток Mg. Жженую магнезию применяют для профилактики и устранения магниевого дефицита, вводя подкормки.
Нахождение в природе
Земля очень богата магнием. Всего шесть химических реагентов встречаются в природе чаще, чем это вещество. Большая часть элемента находится в мантии планеты, в земной коре его меньше. Чаше всего его обнаруживают в основных породах и граните. И также элемент содержится в различных минералах, образованных магмой.
В основном чистый магний добывают из трёх минералов:
- карналлита;
- доломита;
- магнезита.
В России самые большие залежи магнезита находятся на Среднем Урале и в Оренбургской области. Карналлит добывается около города Соликамска, следует отметить, что это месторождение самое крупное в мире. Наиболее распространённый минерал доломит встречается в Московской и Ленинградской областях, а также других регионах страны.
В биологической среде планеты соединения магния постоянно перемещаются и изменяются. Лишь малая часть элемента задерживается в круговороте веществ, происходящем на материках, большое количество реагента уносится реками в океан. Несмотря на то что по содержанию в морской воде магний уступает только натрию, непосредственно сама жидкость не имеет насыщения элементом, а его соли в открытом океане не выпадают в осадок.
Полезные соединения
Соединения магния, в первую очередь оксид магния (MgO), используются в качестве огнеупорного материала в футеровке печей для производства чугуна , стали , цветных металлов , стекла и цемента . Оксид магния и другие соединения магния также используются в сельскохозяйственной, химической и строительной промышленности. Оксид магния от прокаливания используется в качестве электроизолятора в огнестойких кабелях .
Гидрид магния исследуется как способ хранения водорода.
Магний, взаимодействующий с алкилгалогенидом, дает реактив Гриньяра , который является очень полезным инструментом для получения спиртов .
Соли магния входят в состав различных пищевых продуктов , удобрений (магний является компонентом хлорофилла ) и питательных сред для микробов .
Сульфит магния используется при производстве бумаги ( сульфитный процесс ).
Фосфат магния используется для обеспечения огнестойкости древесины, используемой в строительстве.
Гексафторсиликат магния используется для защиты тканей от моли .
Особенности Mg, как элемента периодической системы
Химические свойства магния во многом лежат где-то между бериллием и кальцием. Прежде всего, это проявляется во взаимодействии с водой. Первый не реагирует с ней вообще, второй же в ней растворяется. Mg слабо взаимодействует с нагретой водой. Но при взаимодействии с водяным паром (от 400 градусов по Цельсию) происходит реакция Mg+ H2O = MgO + H2, в которой металл растворяется при активном выделении водорода.
Видео – химические свойства магния:
Несколько иная реакция происходит с водяным паром: Mg+ 2H2O = Mg(OH)2 +H2. Причем свободный водород в итоге поглощается магнием MgH3. В результате, если плавление металла происходило во влажной среде, по мере его застывания водород практически полностью исчезает.
Свойства магния: взаимодействовать с водой при высоких температурах становится и гореть при присутствии в атмосфере углекислого газа, – затрудняют тушение пожаров с участием Mg. Их нельзя тушить водой. По инструкции используют порошковые огнетушители и песок. Также можно применять оксиды Si, с которыми магний вступает в реакцию, но количество выделяемой теплоты значительно ниже.
На фото: горение магния
Также необходимо отметить, что несмотря на фактическую нерастворимость Mg(OH)2 в воде, раствор фенолфталеина в его присутствии окрашивается в розовый цвет.
Магний в таблице Менделеева
Магний металл устойчив к едким щелочам, соде, керосину, бензину, минеральным маслам. Способность этого элемента отнимать кислород и хлор, используют для восстановления чистых веществ. Например, брома или титана.
Для синтезов разных классов органических соединений используется свойство магния взаимодействовать с галогенами. Обычно это Cl, Br, I, с фтором Mg образует защитную пленку, из-за чего их соединение редко используется для синтеза реактивов Гриньяра. Последние наиболее часто формируются на основе формулы RMgHal, где R – это органический радикал, а Hal – один из перечисленных галогенов.
Биологическая роль и токсикология
Магний имеет большое значение для жизни и здоровья человека. Элемент изначально входит в состав живых организмов. Продукты повседневного питания, включая хлеб, молоко, мясо, содержат минимальное количество магния, который обеспечивает и нормализует следующие внутренние процессы:
- белковый синтез;
- работа нервной системы, сердца;
- расширение сосудов;
- отделение желчи;
- функционирование желудочно-кишечного тракта;
- выведение холестерина из организма;
- сокращение мышц.
Магний является составным компонентом хлорофилла. Вещество участвует в процессе фотосинтеза. В хлорофилле содержится примерно 2,7 % магния от общей массы. Вещество сконцентрировано в зеленых частях растительных организмов. Магний влияет на механизм формирования в листьях пигментов, в том числе ксантофилла и каротина. Из него состоит запасное вещество — фитин, который содержат семена растений.
Определена суточная норма магния для взрослых людей. Она составляет 300 мг для женщин и 400 мг — для мужчин. Данная потребность может быть увеличена при наличии следующих факторов:
- психические и физические нагрузки;
- стресс;
- злоупотребление алкоголем;
- потливость.
При поступлении магния в организм усваивается лишь треть от общего количества вещества. Продукты с большой концентрацией магния:
- какао;
- отруби;
- орехи;
- тыквенные семечки;
- зеленые овощи.
При избытке или дефиците магния развиваются такие патологии, как:
- артрит, остеопороз;
- судороги, мышечные спазмы;
- головная боль;
- сбои в работе пищеварительной системы, сердца;
- бессонница, перманентная усталость, раздражительность.
Передозировка магния приводит к следующим последствиям:
- пониженное артериальное давление;
- тошнота, рвота;
- угнетение центральной нервной системы, рефлекторной функции, дыхания;
- кома, паралич дыхательных путей, сердца.
Магний обладает небольшой токсичностью. Опасен в процессе горения. Если смотреть на горящее вещество, можно обжечь сетчатку глаза и временно ослепнуть.
Получение
Обычный промышленный метод получения металлического магния — это электролиз расплава смеси безводных хлоридов магния MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве электрохимическому восстановлению подвергается хлорид магния:
-
- MgCl2 → Mg + Cl2
Расплавленный металл периодически отбирают из электролизной ванны, а в неё добавляют новые порции магнийсодержащего сырья. Так как полученный таким способом магний содержит сравнительно много (около 0,1 %) примесей, при необходимости «сырой» магний подвергают дополнительной очистке. С этой целью используют электролитическое рафинирование, переплавку в вакууме с использованием специальных добавок — флюсов, которые удаляют примеси из магния или перегонку (сублимацию) металла в вакууме. Чистота рафинированного магния достигает 99,999 % и выше.
Разработан и другой способ получения магния — термический. В этом случае для восстановления оксида магния при высокой температуре используют кремний или кокс:
-
- MgO + C → Mg + CO
Применение кремния позволяет получать магний из такого сырья, как доломит CaCO3·MgCO3, не проводя предварительного разделения магния и кальция. С участием доломита протекают реакции, вначале производят обжиг доломита:
-
- CaCO3 ⋅ MgCO3 → CaO + MgO + 2CO2
Затем сильный нагрев с кремнием:
-
- 2MgO + CaO + Si → CaSiO3 + 2Mg
Преимущество термического способа состоит в том, что он позволяет получать магний более высокой чистоты. Для получения магния используют не только минеральное сырьё, но и морскую воду.
Взаимодействие с различными кислотами
Для краткости, проще рассмотреть несколько экспериментов. Для них берутся такие виды кислот:
- Соляная.
- Азотная.
- Серная (разбавленная и нет).

В первом случае наблюдается практически мгновенное растворение, сопровождающееся пузырьками белых газов и резким запахом хлора. Емкость, в которой происходила реакция нагревается.
В азотной кислоте кусочек магния не тонет. Бурый газ скапливается над поверхностью жидкости, выделяется тепло. Иногда говорят, что кислота «кипела», окружая кусочки магния.
Третий случай необходимо рассматривать, как два частных. В неразбавленной серной кислоте реакция идет медленно. Если же использовать раствор с небольшим количеством воды, магний также, как с азотной кислотой плавает на поверхности. При этом происходит едва заметная реакция с выделением белых пузырьков газа.
История открытия
Новая эра развития химии началась в XVII веке. В этот период химик из Англии по фамилии Гро совершил открытие, приблизившее учёных к выделению магния. В 1695 г. во время выпаривания эпсомской минеральной воды он получил горькую соль, обладавшую свойством слабительного.
Через несколько лет исследования показали, что взаимодействие вещества с содой и карбонатом калия даёт белый рыхлый порошок. Этот же результат был получен во время прокаливания минерала, который был найден рядом с городом Магнезия в Греции. Из-за этого сходства соль стали назвать белой магнезией.
Непосредственно магний впервые был получен Хэмфри Дэви в 1808 г. Учёный проводил электролиз белой магнезии, в которую он добавил небольшое количество воды и ртутной окиси. Эта реакция привела к образованию амальгамы металлического вещества. Полученный металл после выведения получил название «магний».
Результаты поиска:
| Химическая реакция | Условия |
| 2HNO3 (разб.) + MgO = Mg(NO3)2 + H2O | |
| MgO + 2HCl (разб.) = MgCl2 + H2O | |
| 2MgO + H2O + CO2 = Mg2CO3(OH)2 | |
| GeO2 + MgO = MgGeO3 | (1200° C) |
| 2MgO + CS2 = 2MgS + CO2 | (600-700° C) |
| Al2O3 + MgO = (MgAl2)O4 | (1600° C) |
| MgO + Cr2O3 = (MgCr2)O4 | (1200-1400° C) |
| MgO + Fe2O3 = (MgFe2)O4 | (1200-1400° C) |
| SiO + 2CaO + MgO = Ca2SiO4 + Mg | (1350° C) |
| Be + MgO = BeO + Mg | (1075° C) |
| MgO + C (кокс) = Mg + CO | (выше 2000° C) |
| MgO + Ca = CaO + Mg | (1300° C) |
| MgO + C (кокс) + Cl2 = MgCl2 + CO | (800-1000° C) |
| MgO + H2O2 (конц.) = MgO2 ↓ + H2O | (до 20° C) |
| MgO + H2O = Mg(OH)2 | |
| MgO + CaC2 = Mg + CaO + 2C | реакция уравнена без электронного баланса |
| 2MgO + 2CaO + Si = Ca2SiO4 + 2Mg | реакция уравнена без электронного баланса |
| MgO + CO + Cl2 = MgCl2 + CO2 | реакция уравнена без электронного баланса |
Оксид магния Пероксид магния
Переизбыток и недостаток
Магний практически безвреден для организма, хотя некоторым его соединениям и присвоен II класс опасности. В основном же металл в разных видах приносит лишь пользу. А страдают люди, животные и растения чаще всего от недостатка или переизбытка вещества.
Когда металла в организме слишком мало, увеличивается риск развития сахарного диабета, болезней почек и кишечника. У людей, страдающих от недостатка микроэлемента, часто болит голова, начинается бессонница, появляются спазмы мышц, быстро наступает утомление. При отсутствии лечения это может привести к различным более серьёзным заболеваниям, повышается возможность заболеть раком.

Прежде чем приступать к восстановлению уровня вещества в организме, необходимо проконсультироваться с врачом и установить степень потребности в веществе. После сдачи анализов доктор назначит переменный или постоянный на протяжении какого-то времени приём соответствующих лекарственных препаратов, принимать которые следует строго по инструкции.
При переизбытке микроэлемента у людей появляются следующие болезни:
- артрит;
- нарушение речи;
- тошнота;
- сонливость;
- и так далее.
Магний относится к жизненно необходимым микроэлементам. Сложно переоценить роль этого вещества в животных и растительных организмах. Его отсутствие в достаточном количестве способно возбудить множество заболеваний.
Свойства магния (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Магний |
| 102 | Прежнее название | |
| 103 | Латинское название | Magnesium |
| 104 | Английское название | Magnesium |
| 105 | Символ | Mg |
| 106 | Атомный номер (номер в таблице) | 12 |
| 107 | Тип | Металл |
| 108 | Группа | Цветной, щёлочноземельный металл |
| 109 | Открыт | Джозеф Блэк, Шотландия, 1755 г., Хемфри Дэви, Великобритания, 1808 г., Антуан Александр Брутус Бюсси, Франция, 1829 г. |
| 110 | Год открытия | 1755 г. |
| 111 | Внешний вид и пр. | Лёгкий, ковкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 2,9 % |
| 120 | Содержание в морях и океанах (по массе) | 0,13 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,06 % |
| 122 | Содержание в Солнце (по массе) | 0,07 % |
| 123 | Содержание в метеоритах (по массе) | 12 % |
| 124 | Содержание в организме человека (по массе) | 0,027 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 24,304-24,307 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 |
| 203 | Электронная оболочка |
K2 L8 M2 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 150 пм |
| 206 | Ковалентный радиус* | 141 пм |
| 207 | Радиус иона (кристаллический) | Mg2+
71 (4) пм, 86 (6) пм, 103 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 173 пм |
| 209 | Электроны, Протоны, Нейтроны | 12 электронов, 12 протонов, 12 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0; +1; +2 |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 1,31 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 737,75 кДж/моль (7,646236(4) эВ) |
| 305 | Электродный потенциал | Mg2+ + 2e– → Mg, Eo = -2,363 В |
| 306 | Энергия сродства атома к электрону | 50 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 1,738 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело),
1,584 г/см3 (при температуре плавления 650 °C и иных стандартных условиях, состояние вещества – жидкость), 1,57 г/см3 (при 651 °C и иных стандартных условиях, состояние вещества –жидкость) |
| 402 | Температура плавления | 650 °C (923 K, 1202 °F) |
| 403 | Температура кипения | 1090 °C (1363 K, 1994 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 8,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 128 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,983 Дж/г·K (при 25 °C), 1,6 Дж/г·K (при 100 °C), 1,31 Дж/г·K (при 650 °C) |
| 410 | Молярная теплоёмкость* | 24,869 Дж/(K·моль) |
| 411 | Молярный объём | 14,0 см³/моль |
| 412 | Теплопроводность | 156 Вт/(м·К) (при стандартных условиях),
156 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки |
Гексагональная плотноупакованная |
| 513 | Параметры решётки | a = 3,2029 Å, c = 5,2000 Å |
| 514 | Отношение c/a | 1,624 |
| 515 | Температура Дебая | 318 К |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-95-4 |
Примечание:
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома магния согласно составляет 160 пм.
206* Ковалентный радиус магния согласно и составляет 141±7 пм и 136 пм соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) магния согласно составляет 9,20 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) магния согласно составляет 131,8 кДж/моль.
410* Молярная теплоемкость магния согласно составляет 24,90 Дж/(K·моль).
Магний (Mg)
Это представитель группы макроэлементов, слабощелочной элемент земли. Известно около 100 минералов, содержащих магний. Это самый распространенный элемент в природе. Он присутствует в верхнем 16-километровом слое земли в количестве около 3,45%.
Соли магния определяют жесткость питьевой воды. Соли магния используются для нейтрализации соляной кислоты в желудке и в качестве лечебного средства при диспепсии и диарее. Раствор сульфата магния применяют парентерально как сосудорасширяющее средство при эклампсии, эпилепсии, тетании, а так же как спазмолитическое средство при анурии, бронхиальной астме, гипертонии и др.
 Дефицит магния способствует развитию остеопороза
Дефицит магния способствует развитию остеопороза
Магний попадает в организм с пищей и водой в дозах 200-400 мг в сутки. До 40-45% всасывается в желудочно-кишечном тракте и около 50% – в крови. Сывороточная концентрация составляет 0,8-1,2 ммоль/л. В теле взрослого человека содержится около 140 г (0,2% массы тела) магния, 2/3 которого находится в скелете. Mg выводится с мочой (50-120 мг) и потом (5-15 мг).
Это важнейший элемент клетки, универсальный регулятор биохимических и физиологических процессов в организме. Магний участвует в обмене энергии, белков и электролитов. Mg активирует более 300 ферментов в качестве кофактора, образуя комплексы с АТФ. Он тормозит отделение окисления от фосфорилирования, участвует в метаболизме белков, жирных кислот, жиров, биосинтезе нуклеиновых кислот и др. процессах.
Магний — это подавляющий стресс, раздражающий мышцы, иммуностимулирующий, антиаритмический, гипотензивный биоэлемент и физиологический антагонист кальция. Не токсичен для человека, смертельная доза неизвестна.
Элемент содержится во многих продуктах животного и растительного происхождения. Гипомагниемия вызывает аритмии и асистолию. Недостаток магния также связан с выводом кальция из организма. Дефицит магния способствует развитию остеопороза. Также может развиваться атеросклероз, слабость, тремор, раздражение мышц и нервов.
Основной источник магния — питьевая вода
Очень важно, чтобы соотношение кальция и магния в пище было 2:1. Гипермагнезия возникает у пациентов с заболеванием почек или надпочечников
Передозировка магниевых добавок опасна для людей с заболеваниями печени.
Магний содержат: зелень, бобовые, цельнозерновые, черный чай, морепродукты, морская капуста, сушеные грибы.
Рекомендуемая суточная доза составляет 300 мг / сут.
История
Название «магний» происходит от греческого слова, обозначающего места, относящиеся к племени Магнетов , или район в Фессалии под названием Магнезия или Магнезия ад Сипилум , ныне находящийся в Турции. Он связан с магнетитом и марганцем , которые также происходят из этой области и требуют дифференциации как отдельные вещества. См. Марганец для этой истории.
В 1618 году фермер из Эпсома в Англии попытался поить своих коров из колодца. Коровы отказывались пить из-за горького вкуса воды, но фермер заметил, что вода, казалось, лечила царапины и сыпь. Вещество стало известно как английская соль, и его слава распространилась. В конечном итоге он был признан гидратированным сульфатом магния, MgSO.4· 7 H2O .
Сам металл был впервые выделен сэром Хэмфри Дэви в Англии в 1808 году. Он применил электролиз на смеси магнезии и оксида ртути . Антуан Бюсси подготовил его в последовательной форме в 1831 году. Первым предложением Дэви для названия было магний, но теперь используется название магний.
Сила: что это за величина
В повседневной жизни мы часто встречаем, как любое тело деформируется (меняет форму или размер), ускоряется или тормозит, падает. В общем, чего только с разными телами в реальной жизни не происходит. Причиной любого действия или взаимодействия является сила.
Сила — это физическая векторная величина, которую воздействует на данное тело со стороны других тел.
Она измеряется в Ньютонах — это единица измерения названа в честь Исаака Ньютона.
Сила — величина векторная. Это значит, что, помимо модуля, у нее есть направление. От того, куда направлена сила, зависит результат.
Вот стоите вы на лонгборде: можете оттолкнуться вправо, а можете влево — в зависимости от того, в какую сторону оттолкнетесь, результат будет разный. В данном случае результат выражается в направлении движения.
Список марок
Сегодня в России зарегистрировано около 800 наименований минералок. К тому же огромное число целебных вод импортируется из других стран.
Наиболее известные сульфатно-магниевые минеральные воды:
- «Донат Mg». Добывается в Словении. Общее солесодержание 10-15 г/л. Помимо SO4- (до 2700 мг/л) и Mg+ (до 1200 мг/л) содержит соли HCl и HCO3, Na, Ca. Активно применяется в лечебно-профилактических учреждениях и самостоятельно на дому.
Курсы с водой «Донат Mg» назначаются врачами для нормализации пищеварения, повышения стрессоустойчивости, укрепления сердечной мышцы и т.д. Рекомендуется больным подагрой и людям, страдающим от изжоги и запоров.
- «Шифалы-Су». Место сбора находится в Менделеевском районе Республики Татарстан. Лечебно-столовая (общее количество солей 4-6 г/л). Включает в состав до 300 мг/л Mg+ и до 2500 мг/л SO4-. А также K+, Na+, CO3-, Cl-. Выписывается для лечения органов ЖКТ и при нарушении метаболизма.
- «Нарзан». Вода с небольшой концентрацией солей, которая может использоваться как для ежедневного употребления, так и для лечебных целей. Солесодержание 2-3 г/л. Место рождения – предгорье Кавказа. Содержит в составе SO4- до 500 мг/л, до 120 мг/л Mg+.
- «Баталинская». Насыщенный солевой раствор (21-23 г/л). Добывается в Ставропольском крае на заповедной территории. В составе есть SO4-, Na+, Mg+. Предназначена для лечения органов пищеварения.
- «Кашинская водица». Добывается в Тверской области. Лечебно-столового назначения (2-4 г/л). SO4- – 1500-2500 мг/л, Mg+ – 100-200 мг/л. в составе есть солиHCO3, Na, K, Cl. Используется для лечения болезней желудка, кишок, печени, желчного пузыря, мочевыводящих путей.
В клинических рекомендациях специалистами выписываются только солевые растворы без газа.
Магниевые «нобели»: реактив Гриньяра
Неорганические соединения магния хорошо известны. О некоторых (всевозможных магнезиях) мы уже рассказали. Среди самых важных минералов магния нужно назвать доломит (карбонаты кальция и магния), бишофит (водный хлорид магния), брусит (гидроксид магния). Иногда среди минералов магния называют… морскую воду. С другой стороны, его там достаточно много – около 0,12% Но, пожалуй, самые интересные (и самые важные) для нас – органические соединения магния.
Рассказывая об них, не нужно забывать, что органическая химия этого металла принесла исследователям четыре (можно сказать, что и пять с половиной) Нобелевские премии. Но, конечно, самый главный «магниевый нобель» был вручен в 1912 году Виктору Гриньяру.

Виктор Гриньяр
Гриньяр получил высшее физическое образование и собирался работать школьным учителем. Но завалил экзамены на лицензию, «сходил» в армию… А когда вернулся, ему встретился школьный приятель, Луи Руссе, уже ставший учителем химии. Он и убедил Гриньяра, что химия — это круто.
Руссе рассказал другу, что открылась вакансия ассистента химического факультета на кафедре профессора Филиппа Барбье. Виктор поспешил занять эту вакансию. Впрочем, поначалу Гриньяру казалось, что вся химия — это эмпирическая наука, бессистемная и требующая огромного количества памяти (благодаря учителям химии подавляющее большинство современных школьников именно так и считает), однако потом внутренняя структура науки начала проступать, и наш герой начал показывать выдающиеся успехи.
Барбье был очень хорошим ученым и сильной личностью и умел ценить таких же. Он быстро начал привлекать ассистента кафедры к исследованиям и в 1900 году попросил его попробовать еще раз сделать работы по металлоорганической химии, в которых у него уже несколько лет наблюдались трудности.
Чем занимался Барбье? Он пытался усовершенствовать реакцию Зайцева — присоединение к углероду при кетоновой группе цинкорганических соединений с образованием третичных спиртов и новой связи «углерод – углерод». В те годы вообще единственными металлоорганическими соединениями (органическими веществами, в которых присутствует связь «углерод-металл») была цинкорганика. За одним единственным исключением.
Учитель Гриньяра попытался заменить в этой реакции цинк магнием, потому что знал, что в 1898 году в Германии получили соединения R-Mg-R (R — это углеводородный радикал: метил, этил и так далее), но они получались с непредсказуемым выходом и были нестабильны. Впрочем, у Барбье особо ничего не получилось: он попытался проводить реакцию с двумя органическими веществами в присутствии магния. Реакция, конечно, получалась, но шла непредсказуемо.
Как потом вспоминал сам Гриньяр, Барбье был очень плодовитым на идеи, но если работа сразу же «не шла», то химик охладевал к ней и брал следующую идею. Поэтому Барбье «скинул» эту работу на Гриньяра.
Молодой ученый уперся в те же проблемы, что и учитель, но потом его осенило: а что, если получить магнийорганику не прямо в реакции, как при реакции Зайцева, а получить промежуточное вещество заранее. И внезапно оказалось, что реакция RX+Mg = R-Mg-X (X – это галоген: хлор, бром, йод) идет в растворе очень легко, а полученные вещества идеально реагируют с кетонами и вообще с очень многими органическими соединениями. Так у органиков появился очень мощный метод для направленного органического синтеза. Им пользуются до сих пор, а вещества R-Mg-X везде, кроме Франции, получили название «реактив Гриньяра».
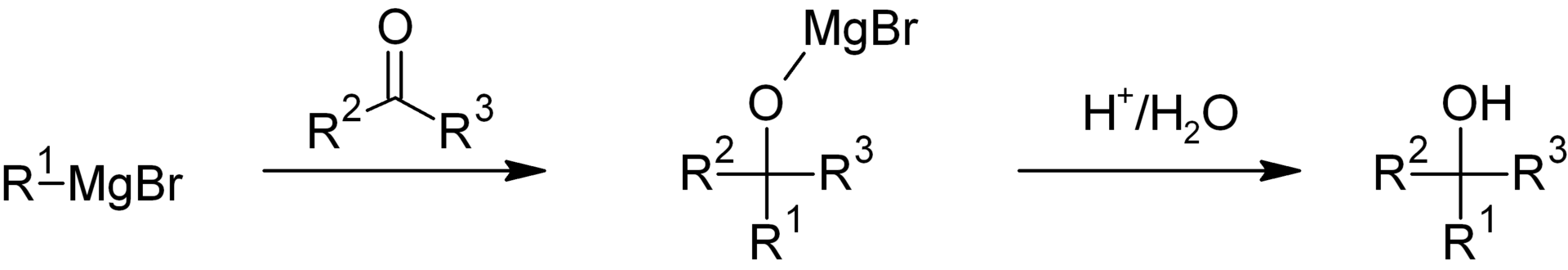
Работа Гриньяра произвела эффект разорвавшейся бомбы. В 1900 году вышла его статья в журнале Comptes Rendus de l’Académie des sciences, и он был ее единственным автором. Этот факт стал, кстати, поводом для серьезной полемики во Франции: почему же Барбье, поставивший задачу, не стал соавтором. По воспоминаниям нашего героя, ему это было просто неинтересно.
Любопытно, что свою степень по химии Гриньяр получил только в 1901 году, когда он стал уже всемирно знаменит. Правда, он озаботился защитой своих интеллектуальных прав: в 1900 году, сразу после открытия своей реакции, Гриньяр попросил двух французских академиков, Анри Муассана (Нобелевская премия 1906 года) и Марелена Бертло о защите своего открытия. Оба написали ему: никак без публикаций защитить свой приоритет не получится. Гриньяр внял совету, заручился поддержкой в публикациях статей, и с 1900 по 1904 год опубликовал четырнадцать.
Надо сказать, влияние на развитие химии эти публикации оказали немалое: только за его «нобелевский» 1912 год было опубликовано 700 статей, посвященных применению реактива Гриньяра. Поэтому Нобелевская премия была абсолютно по делу.
Особенности Mg, как элемента периодической системы
Химические свойства магния во многом лежат где-то между бериллием и кальцием. Прежде всего, это проявляется во взаимодействии с водой. Первый не реагирует с ней вообще, второй же в ней растворяется. Mg слабо взаимодействует с нагретой водой. Но при взаимодействии с водяным паром (от 400 градусов по Цельсию) происходит реакция Mg+ H2O = MgO + H2, в которой металл растворяется при активном выделении водорода.
Видео – химические свойства магния:
https://youtube.com/watch?v=N01lJEkPP74
Несколько иная реакция происходит с водяным паром: Mg+ 2H2O = Mg(OH)2 +H2. Причем свободный водород в итоге поглощается магнием MgH3. В результате, если плавление металла происходило во влажной среде, по мере его застывания водород практически полностью исчезает.
Свойства магния: взаимодействовать с водой при высоких температурах становится и гореть при присутствии в атмосфере углекислого газа, – затрудняют тушение пожаров с участием Mg. Их нельзя тушить водой. По инструкции используют порошковые огнетушители и песок. Также можно применять оксиды Si, с которыми магний вступает в реакцию, но количество выделяемой теплоты значительно ниже.
На фото: горение магния
Также необходимо отметить, что несмотря на фактическую нерастворимость Mg(OH)2 в воде, раствор фенолфталеина в его присутствии окрашивается в розовый цвет.
Магний в таблице Менделеева
Магний металл устойчив к едким щелочам, соде, керосину, бензину, минеральным маслам. Способность этого элемента отнимать кислород и хлор, используют для восстановления чистых веществ. Например, брома или титана.
Для синтезов разных классов органических соединений используется свойство магния взаимодействовать с галогенами. Обычно это Cl, Br, I, с фтором Mg образует защитную пленку, из-за чего их соединение редко используется для синтеза реактивов Гриньяра. Последние наиболее часто формируются на основе формулы RMgHal, где R – это органический радикал, а Hal – один из перечисленных галогенов.






