Показания к проведению кислородной терапии
Оксигенотерапия нужна людям с болезнями сердца, сосудов и дыхательной системы. Ингаляции с применением концентрированной смеси оксигена показаны при:
- дыхательной недостаточности;
- гипертензии легких;
- муковисцидозе;
- бронхиальной астме;
- сердечной недостаточности;
- ХОБЛ.
Доктор назначает дыхательную кислородотерапию пациентам зависимо от течения и характера болезни (длительность одной процедуры варьируется от получаса до 60 минут).
Во время вдыхания 95% бесцветного газа компенсируется гипоксия, возникающая при сердечной и дыхательной недостаточности. С помощью манипуляции у пациентов уходит одышка, нормализуется работа сердца, печени и почек. Несколько сеансов оксигенотерапии способны восстановить оксигенацию при хронической обструктивной болезни легких.
Ученые провели ряд исследований и выявили, что с помощью кислородного лечения длительность жизни больных людей увеличивалась на 6-7 лет, снижалась вероятность возникновения обострений, уменьшалось количество госпитализированных людей.
Концентраторы кислорода в современной медицине стали достойной заменой баллонов, используемых еще несколько лет назад для лечения болезней легких. Процедура нужна людям после хирургического вмешательства и во время восстановления после недугов. Кислородные ингаляции укрепляют иммунитет и ускоряют процесс реабилитации после сложных операций.
Манипуляции с применением кислородного концентратора показаны не только больным, но и здоровым людям. Это связано с состоянием экологии и проживанием в городах, где воздух загрязняют транспортные средства и опасные химические заводы. Поэтому люди, живущие в мегаполисах, нередко испытывают дефицит оксигена. В результате, жители городов чрезмерно устают, у них появляется мигрень, сонливость, раздражительность, бледность кожных покровов. Гипоксию можно устранить даже в домашних условиях с помощью ингаляций и приема специальных коктейлей.
Врачи рекомендуют оксигенотерапию детям, так как во время активного роста организму ребенка необходимо повышенное поступление кислорода, иначе есть риск ослабления иммунной системы и снижения успеваемости.
Маленьким детям педиатры нередко назначают кислородное лечение в виде напитков. Питье, в основе которого травяной отвар или сок, обогащенный оксигеном, очень полезное и вкусное. Насыщенные кислородом напитки и ингаляции назначаются:
- женщинам во время вынашивание ребенка;
- людям, занимающимися различными видами спорта;
- худеющим;
- курильщикам;
- пожилым женщинам и мужчинам.
У кислородотерапии противопоказаний нет, но она должна проводиться только после беседы с доктором. Чтобы не появилось побочных эффектов, нужно не пренебрегать назначенным режимом, дозировкой и длительностью манипуляций.
При индивидуальной чувствительности к компонентам коктейля также не рекомендуется его употребление.
Получение
Перегонка жидкого воздуха
В настоящее время в промышленности кислород получают из воздуха.
Основным промышленным способом получения кислорода является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
- 2KMnO4→tK2MnO4+MnO2+O2↑{\displaystyle {\ce {2KMnO4 -> K2MnO4 + MnO2 + O2 ^}}}
Используют также реакцию каталитического разложения пероксида водорода H2O2 в присутствии оксида марганца(IV):
- 2H2O2→MnO22H2O+O2↑{\displaystyle {\ce {2H2O2 -> 2H2O + O2 ^}}}
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
- 2KClO3⟶2KCl+3O2↑{\displaystyle {\ce {2KClO3 -> 2KCl + 3O2 ^}}}
Разложение оксида ртути(II) (при t = 100 °C) было первым методом синтеза кислорода:
- 2HgO→100°C2Hg+O2↑{\displaystyle {\ce {2HgO -> 2Hg + O2 ^}}}
Электролиз водных растворов
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
- 2H2O→e−2H2↑+O2↑{\displaystyle {\ce {2H2O -> 2H2 ^ + O2 ^}}}
Реакция перекисных соединений с углекислым газом
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
- 2Na2O2+2CO2⟶2Na2CO3+O2↑{\displaystyle {\ce {2Na2O2 + 2CO2 -> 2Na2CO3 + O2 ^}}}
Для соблюдения баланса объёмов поглощённого углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Особенности использования жидкого кислорода
Хотя О2 в жидком состоянии не обладает токсическими свойствами, существует строгий перечень мер безопасности по работе с элементом:
- контактируя с жидким кислородом, а также с кислородными резервуарами, необходимо использовать специальные защитные средства; к ним относятся комбинезоны, рукавицы, кожаная обувь, которые могут варьироваться в зависимости от времени года;
- при работе с жидким веществом защитные средства должны предварительно обрабатываться для исключения контакта элемента с жирами и маслами, в противном случае реакция может создать взрывоопасную смесь;
- при выполнении сварочных или ремонтных работ в помещениях, где хранится О2, необходимо регулярно осуществлять проветривания теплым воздухом;
- при заливке О2 в резервуары для хранения или транспортировки емкости следует предварительно обезжирить;
- при перекачке вещества выполняется предварительное охлаждение системы на жидком кислороде с малым числом вещества: это необходимо для того, чтобы исключить возгорание оборудования при резких перепадах давления.
Все эти проблемы использования О2 в жидком состоянии не нужно решать, если использовать кислород в газообразном виде.
Компания «Сварочные технологии» осуществляет поставки кислородного оборудования, которое позволит вам самостоятельно получать кислород (O2) в газообразном состоянии.
Чтобы задать дополнительные вопросы относительно продукции и услуг компании, свяжитесь с нашими специалистами любыми удобными для Вас способами.
По вопросам заказа оборудования просим Вас заполнить Запрос на оборудование
или отправить Вашу заявку на электронный адрес: info@rezkasvarka.ru.
При возникновении вопросов обращайтесь по тел. +7 (495) 648-91-23
Мы будем рады сотрудничеству с Вами!
[править] Биологическая роль кислорода
Большинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену (кислородный коктейль). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьезных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, легочной вентиляции.
Мобильность превыше всего
Первая и основная причина использования кислородных баллончиков — это их удобство. Их компактность позволяет оставаться мобильными тем, кому доктор рекомендовал использовать газовую кислородную смесь в дополнение к основному лечению. Согласитесь, ведь не так удобно передвигаться по улице с кислородной подушкой или кислородным концентратором. Многим пациентам, вынужденным использовать источники кислорода, также требуется мобильность в передвижении, чтобы не быть изолированными от общества и тем самым не подвергаться риску психологических расстройств, вызванных вынужденным «заточением».
Газ кислород
Кислород – один из важнейших элементов на планете. Он участвует в процессе дыхания, в метаболизме живых организмов, а также в круговороте веществ в биосфере. Кроме того, он способствует гниению и разложению органических остатков.
В нормальных условиях он является бесцветным газом, который не имеет вкуса и запаха. Он тяжелее воздуха и с трудом растворяется в воде. В химическом плане он очень активен и способен образовывать соединения практически со всеми элементами.
В свободном состоянии в виде молекул О2, состоящих из двух атомов оксигена, он находится в атмосфере. Благодаря такому строению элемент также называется «дикислородом», но он может существовать и в других вариациях. При определенных условиях его атомы могут образовывать «трикислород» с молекулой О3, которая представляет собой голубой газ озон со специфическим запахом.
В атмосфере содержание кислорода составляет примерно 21 % по массе, в земной коре его доля значительно выше и составляет около 47 % по массе. Элемент входит в состав более полутора тысяч разнообразных пород и минералов, большая часть из которых являются силикатами. Там он присутствует в виде соединений. В воде его содержание доходит до 85 %, и это не удивительно, ведь атомы оксигена и образуют воду вместе с элементом гидрогеном.

Химические свойства
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона. Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
- 4Li + O2 → 2Li2O
- 2Sr + O2 → 2SrO
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
- 2NO + O2 → 2NO2↑
Окисляет большинство органических соединений в реакциях горения:
- 2C6H6 + 15O2 → 12CO2 + 6H2O
- CH3CH2OH + 3O2 → 2CO2 + 3H2O
При определённых условиях можно провести мягкое окисление органического соединения:
- CH3CH2OH + O2 → CH3COOH + H2O
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #Фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- 2Na + O2 → Na2O2
Некоторые оксиды поглощают кислород:
- 2BaO + O2 → 2BaO2
По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
- H2 + O2 → H2O2
В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O− 2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Na2O2 + O2 → 2NaO2
Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
- K + O2 → KO2
Неорганические озониды содержат ион O− 3 со степенью окисления кислорода, формально равной −1/3. Получают действием озона на гидроксиды щелочных металлов:
- 3KOH + 3O3 → 2KO3 + KOH ∗ H2O + 2O2↑
В ионе диоксигенила O2+ кислород имеет формально степень окисления +½. Получают по реакции:
- PtF6 + O2 → O2PtF6
В этой реакции, кислород проявляет восстановительные свойства.
Фториды кислорода
Дифторид кислорода, OF2 степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щёлочи:
- 2F2 + 2NaOH → 2NaF + H2O + OF2↑
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
- F2 + O2 → O2F2
- Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
- Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония OF3+. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3.
Химические свойства
Кислород является химически активным веществом. Он способен вступать в реакции с множеством других веществ, однако для протекания большинства этих реакций необходима более высокая, чем комнатная, температура. При нагревании кислород реагирует с неметаллами и металлами.
Если стеклянную колбу наполнить кислородом и внести в нее ложечку с горящей серой, то сера вспыхивает с образованием яркого пламени и быстро сгорает (рис. 80).

Химическую реакцию, протекающую в этом случае, можно описать следующим уравнением:
В результате реакции образуется вещество SO2, которое называется сернистым газом. Сернистый газ имеет резкий запах, который вы ощущаете при зажигании обычной спички. Это говорит о том, что в состав головки спички входит сера, при горении которой и образуется сернистый газ.
Подожженный красный фосфор в колбе с кислородом вспыхивает еще ярче и быстро сгорает, образуя густой белый дым (рис. 81).

При этом протекает химическая реакция:
Белый дым состоит из маленьких твердых частиц продукта реакции — P2O5.
Если в колбу с кислородом внести тлеющий уголек, состоящий в основном из углерода, то он также вспыхивает и сгорает ярким пламенем (рис. 82).

Протекающую химическую реакцию можно представить следующим уравнением:
Продуктом реакции является CO2, или углекислый газ, с которым вы уже знакомы. Доказать образование углекислого газа можно, добавив в колбу немного известковой воды. Помутнение свидетельствует о присутствии CO2 в колбе.
Возгорание уголька можно использовать для отличия кислорода от других газов. Если в сосуд (колбу, пробирку) с газом внести тлеющий уголек и он вспыхнет, то это указывает на наличие в сосуде кислорода.
Кроме неметаллов, с кислородом реагируют и многие металлы. Внесем в колбу с кислородом раскаленную стальную проволоку, состоящую в основном из железа. Проволока начинает ярко светиться и разбрасывать в разные стороны раскаленные искры, как при горении бенгальского огня (рис. 83).

При этом протекает следующая химическая реакция:
В результате реакции образуется вещество Fe3O4 (железная окалина). В состав формульной единицы этого вещества входят три атома железа, причем один из них имеет валентность II, а два других атома имеют валентность III. Поэтому формулу этого вещества можно представить в виде FeO * Fe2O3.
Реакцию железа с кислородом используют для резки стальных изделий. Для этого определенный участок детали сначала нагревают с помощью кислородногазовой горелки. Затем направляют на нагретое место струю чистого кислорода, для чего перекрывают кран поступления горючего газа в горелку. Нагретое до высокой температуры железо вступает в химическую реакцию с кислородом и превращается в окалину. Так можно разрезать очень толстые железные детали.
Химические свойства кислорода
Во всех реакциях кислород играет роль окислителя, соединяясь со всеми элементами (за исключением гелия, аргона и неона) непосредственным взаимодействием (кроме фтора, хлора, золота и платиновых металлов).
С металлами и неметаллами (простыми веществами) кислород образует оксиды:
2Cu + O2 = 2CuO 4Li + O2 = 2Li2O 2Ca + O2 = 2CaO S + O2 = SO2 C + O2 = CO2
При окислении щелочных металлов натрия и калия образуются пероксиды:
2Na + O2 = Na2O2
Практически все реакции с участием кислорода являются экзотермическими, но есть и исключения:
N2+O2 2NO-Q
Многие вещества реагируют с кислородом с большим выделением тепла и света, такой процесс называется горением.
Реакции горения:
- горение аммиака на воздухе с образованием воды и азота:
4NH3+3O2 = 2N2+6H2O
- каталитическое окисление аммиака:
4NH3+5O2 = 2NO+6H2O
- горение сероводорода в избытке кислорода:
2H2S+3O2 = 2SO2+2H2O
- при недостатке кислорода сероводород медленно окисляется до свободной серы:
2H2S+O2 = 2S+2H2O
- горение органических веществ в кислороде с образованием воды и углекислого газа:
CH4+2O2 → CO2+2H2O C2H5OH+3O2 → 2CO2+3H2O
- при сгорании азотсодержащих органических веществ кроме углекислого газа и воды выделяется свободный азот:
4CH3NH5+9O2 → 4CO2+2N2+10H2O
Многие вещества (спирты, альдегиды, кислоты) получают реакцией контролируемого окисления органических веществ. Также многие природные процессы, например, дыхание или гниение, по своей сути являются окислительными реакциями органических веществ.
O3+2KI+H2O = I2↓+2KOH+O2↑
Физические свойства жидкого кислорода
В жидком состоянии кислород имеет бледно-голубой оттенок. При переливании из одной емкости в другую жидкий кислород выделяет водяные пары, поглощая тепло из окружающего воздуха. При этом температура воздуха резко снижается, что приводит к образованию тумана.
Этот вид кислорода способен закипать при температуре 183°С. Если в это время поместить его в среду, в которой температура воздуха составляет около 30-40°С, то кипение лишь усилится. При комнатной температуре жидкость быстро испаряется.
Для того чтобы снизить скорость испарения кислорода жидкого, его помещают в специальные баллоны. Баллон для хранения О2 представляет собой двухслойный сосуд. Внутренняя стенка баллона покрыта слоем серебра, а между ней и внешней стенкой полностью выкачан весь воздух. Слой серебра необходим для того, чтобы отражать тепло. В таком баллоне кислород может храниться на протяжении нескольких суток.
К другим физическим свойствам жидкого кислорода можно отнести следующие:
- температура кипения – -183°С,
- критическое давление – 497 атмосфер,
- температура плавления – -219°С,
- температура затвердевания – -220°С.
Методы получения
Способ производства кислорода зависит от того, какое количество газа требуется получить. Лабораторные методы следующее:
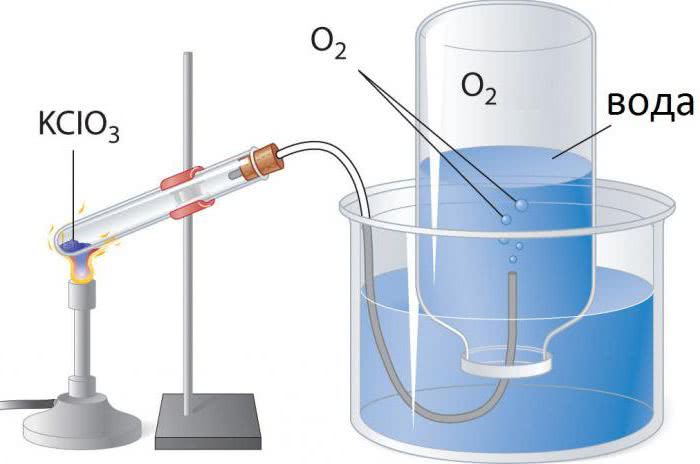
1. Термическое разложение некоторых солей, таких как хлорат калия или нитрат калия:
- 2KClO3 → 2KCl + 3O2.
- 2KNO3 → 2KNO2 + O2.
Разложение хлората калия катализируется оксидами переходных металлов. Для этого часто используется диоксид марганца (пиролюзит, MnO2). Катализатор снижает температуру, необходимую для выделения кислорода, с 400 до 250 °С.
2. Разложение оксидов металлов под действием температуры:
- 2HgO → 2Hg + O2.
- 2Ag2O → 4Ag + O2.
Шееле и Пристли для получения этого химического элемента использовали соединение (оксид) кислорода и ртути (II).
3. Термическое разложение металлических пероксидов или перекиси водорода:
- 2BaO + O2 → 2BaO2.
- 2BaO2 → 2BaO +O2.
- BaO2 + H2SO4 → H2O2 + BaSO4.
- 2H2O2 → 2H2O +O2.
Первые промышленные методы выделения кислорода из атмосферы или для производства перекиси водорода зависели от образования пероксида бария из оксида.
4. Электролиз воды с небольшими примесями солей или кислот, которые обеспечивают проводимость электрического тока:
2H2O → 2H2 + O2
Физические свойства кислорода
При взаимодействии двух атомов кислорода образуется устойчивая молекула простого вещества кислорода O2. Данное простое вещество, как и элемент, называется кислородом. Не путайте кислород-элемент, и кислород – простое вещество!
По физическим свойствам кислород – бесцветный газ без запаха и вкуса. Практически нерастворим в воде (при комнатной температуре и нормальном атмосферном давлении растворимость кислорода составляет около 8 мг на один литр воды). Кислород растворим в воде – в 1 л воды при температуре 20°С растворяется 31 мл кислорода (0,004% по массе). Однако этого количества достаточно для дыхания рыб, живущих в водоемах. Газообразный кислород немного тяжелее воздуха:
1 л воздуха при температуре 0°С и обычном давлении весит 1,29 г, а 1 л кислорода – 1,43 г.
Кислород проявляет интересные свойства при сильном охлаждении. Так, при температуре –183°С кислород конденсируется в прозрачную подвижную жидкость бледно- голубого цвета. Если жидкий кислород охладить еще сильнее, то при температуре –218°С кислород «замерзает» в виде синих кристаллов. Если температуру постепенно повышать, то при –218°С, твердый кислород начнет плавится, а при –183°С – закипит. Следовательно, температуры кипения и конденсации, а также температуры замерзания и плавления для веществ являются одинаковыми.
Для хранения и транспортировки жидкого кислорода используют так называемые сосуды Дьюара. Сосуды Дьюара используют для хранения и транспортировки жидкостей, температура которых должна длительное время оставаться постоянной. Сосуд Дьюара носит имя его изобретателя, шотландского физика и химика Джеймса Дьюара. Простейшим сосудом Дьюара является бытовой термос. Устройство сосуда довольно простое: это колба, помещенная в большую колбу. Из герметичного пространства между колбами откачивается воздух. Благодаря отсутствию воздуха между стенками колб, жидкость, налитая во внутреннюю колбу, долгое время не остывает или не нагревается.
Кислород — парамагнитное вещество, то есть в жидком и твердом состояниях он притягивается магнитом
В природе существует еще одно простое вещество, состоящее из атомов кислорода. Это озон. Химическая формула озона О3.
Озон, так же как и кислород, в обычных условиях – газ. Озон образуется в атмосфере во время грозовых разрядов. Характерный запах свежести после грозы является запахом озона. Если озон получить в лаборатории и собрать значительное количество его, то в больших концентрациях озон будет иметь резкий неприятный запах. Получают озон в лаборатории в специальных приборах – озонаторах.
Озонатор – это стеклянная трубка, в которую подают ток кислорода, и создают электрический разряд. Электрический разряд превращает кислород в озон: В отличие от бесцветного кислорода, озон – газ голубого цвета. Растворимость озона в воде составляет около 0,5 л газа на 1 литр воды, что значительно больше, чем у кислорода. С учетом этого свойства озон применяется для обеззараживания питьевой воды, так как оказывает губительное действие на болезнетворные микроорганизмы.
При низких температурах, озон ведет себя аналогично кислороду. При температуре –112°С он конденсируется в жидкость фиолетового цвета, а при температуре –197°С кристаллизуется в виде темно-фиолетовых, почти черных кристаллов Таким образом, можно сделать вывод, что атомы одного и того же химического элемента могут образовывать разные простые вещества.
Простые вещества, образованные одним и тем же элементом, называют аллотропными модификациями
Значит, кислород и озон – аллотропные модификации химического элемента кислорода. Существуют данные, что при сверхнизких температурах, в жидком или твердом состоянии кислород может существовать в виде молекул О4 и О8.
Элемент в окружающей среде
Земная кора состоит в основном из кремниево-кислородных минералов, и многие другие элементы присутствуют в виде их оксидов. Газообразный кислород составляет пятую часть атмосферы. О2 в атмосфере Земли образуется в результате фотосинтеза растений, он накапливался в течение длительного времени, поскольку они использовали обильные запасы углекислого газа в ранней атмосфере и выделяли кислород.

Почти все химические вещества, кроме инертных газов, связываются с кислородом с образованием соединений. Вода, H2O и кремнезём, SiO2, основной компонент песка, являются одними из наиболее распространённых двойных кислородных соединений. Среди соединений, которые содержат более двух элементов, наиболее распространёнными являются силикаты, которые образуют большинство пород и почв. Другими соединениями, которые в изобилии встречаются в природе, являются карбонат кальция (известняк и мрамор), сульфат кальция (гипс), оксид алюминия (боксит) и различные оксиды железа, которые используются в качестве источника металла.
Элемент встречается во всех видах минералов. Некоторые общие примеры включают оксиды, карбонаты, нитраты, сульфаты и фосфаты. Оксиды — это химические соединения, которые содержат кислород и ещё один элемент. Карбонаты — это соединения, которые содержат кислород, углерод и ещё один элемент. В качестве примера можно привести карбонат натрия или соду, кальцинированную соду или солевую соду (Na2CO3), которая часто встречается в моющих и чистящих средствах.
Нитраты, сульфаты и фосфаты также содержат кислород. Другими элементами в этих соединениях являются азот, сера или фосфор плюс ещё один элемент. Примерами этих соединений являются нитрат калия или селитра (KNO3), сульфат магния или соли Эпсома (MgSO4) и фосфат кальция (Ca3 (PO 4)2).
Химические свойства
При стандартной температуре и давлении два атома элемента связываются, образуя диоксид кислорода, двухатомный газ без цвета, запаха и вкуса, с формулой O2. Этот элемент является членом группы халькогенов в периодической таблице Менделеева и является высокореактивным неметаллическим элементом. Он легко образует соединения (в частности, оксиды) почти со всеми другими элементами.
Кислород является сильным окислителем и обладает второй по величине электроотрицательностью среди всех реактивных элементов, уступая только фтору. По массе кислород является третьим по распространённости элементом во вселенной после водорода и гелия и наиболее распространённым по массе элементом в земной коре, составляя почти половину массы земной коры. Свободный кислород химически реактивен, чтобы появляться на Земле без фотосинтетического действия живых организмов, которые используют энергию солнечного света для производства элементарного кислорода из воды.
Элементарный O2 начал накапливаться в атмосфере только после эволюционного появления фотосинтезирующих организмов, примерно 2,5 миллиарда лет назад. Двухатомный газообразный кислород в настоящее время составляет 20,8% от объёма воздуха.
Наиболее важными химическими свойствами кислорода являются:

- Поддержание горения. Он помогает другим объектам гореть. Сжигание древесного угля является примером. Древесный уголь — практически чистый углерод.
- Соединяется с элементами при комнатной температуре. Ржавчина является примером. Ржавчина — это процесс, при котором металл соединяется с О2.
- Реагирует со многими соединениями. Распад — это процесс, благодаря которому некогда живое вещество соединяется с кислородом. Продуктами распада являются в основном диоксид углерода (CO2) и вода (H2O):
Терапевтические методы
Клинические испытания озонотерапии показали, что эта терапия снижает кислородный стресс в организме, деактивирует вирусы, такие как ВИЧ, и борется с бактериальными инфекциями, все из которых связаны с образованием рака. Кислородная терапия используется для лечения хронических болей, вызванных повреждением нервов. Как назначается озоновая терапия? Есть три способа:
* Капельница с озоном: жидкость, насыщенная озоном, вводится непосредственно в кровоток.
* Аутогемотерапия: из организма берут от 10 до 15 миллилитров крови, насыщают озоном и вводят обратно.
* Озоновая сауна: тело окружено теплым влажным паром, который открывает поры, через которые озон попадает в кровоток.
Самыми инвазивными являются, конечно, прием капельницы и аутогемотерапия, потому что они используют иглы и берут кровь, что отталкивает некоторых людей. Озоновая сауна, с другой стороны, является самым простым и легким способом организации в домашних условиях и, кроме того, самым эффективным по нескольким причинам: 1) озоновая сауна подвергает все тело воздействию озона через самый обширный орган тела — кожу, и 2) дополнительным преимуществом использования озоновой сауны является то, что она согревает тело, что имеет гипертермический эффект. Вместе озонотерапия и гипертермия способствуют глубокому проникновению в ткани организма и насыщают кислородом кровь и клетки, извлекают токсины и улучшают функционирование клеток.
Очень важно очистить лимфатическую ткань от токсинов, и сауна с озоном и паром— это самый простой и лучший способ сделать это. Доктор Джон Харви Келлогг в своей книге написал: «Вероятно, никакое дезинфицирующее средство для воздуха в больнице не так полезно, как озон, одно из самых эффективных дезинфицирующих средств, которые мы знаем»
Известный ученый и изобретатель Никола Тесла тоже оценил озон и построил первый в мире генератор озона в 1896 году. В 1900 году он ввел озонированное оливковое масло, которое продавал врачам в медицинских целях. В течение следующих нескольких десятилетий озон использовался для лечения многих проблем — анемии, астмы, мочевыводящих путей, диабета, бессонницы, туберкулеза и многих видов рака. Уникальность озона в том, что он является катализатором для снабжения клеток кислородом и, следовательно, энергией. Озон стимулирует полезные изменения во всей иммунной системе, обеспечивая клетки большим количеством кислорода, чтобы они могли выполнять свои метаболические и антитоксические функции в соответствии с назначением.
Озон делает все это, не повреждая здоровые клетки. Защитные ферменты, которые образуются из озона, помогают защитить здоровые клетки от разрушения во время очищения. Озон дает здоровым клеткам защиту, в которой они нуждаются, прежде чем они подвергнуться вторжению бактерий, вирусов и раковых клеток, загрязняющих организм. Вот что говорится в исследовании, опубликованном в 1980 году в журнале «Science» о селективном воздействии озона на раковые клетки, даже когда озон находится в воздухе: «Контакт … с озоном сократил рост раковых клеток более чем на 90%… Очевидно, что в раковых клетках человека нарушен механизм защиты от повреждения озоном». Раковые клетки не переносят озон и буквально умирают при его наличии. Здоровые клетки, с другой стороны, не только невосприимчивы к повреждениям, но даже обогащены присутствием озона.
[править] Распространение в природе
Кислород — самый распространенный на Земле элемент, содержание его составляет 47 % по массе (в основном в форме оксидов), в воздухе (тропосфере) кислорода (O2) — 20,93 % по объему, или 23 % по массе. В состав воды входит 88,8 % кислорода, в морской воде — 85,7 %. Он входит в состав большинства горных пород, почв, а также клеток всех растительных и животных организмов. Кислород в целом составляет 30-85 % массы животных и растительных тканей. Он входит в состав белков, нуклеиновых кислот, жиров, углеводов и т. п. Свободный кислород играет большую роль в биохимических и физиологических процессах, в частности в дыхании. При недостаточном снабжении организма животных и человека кислородом развивается гипоксия. Зеленые растения и некоторые бактерии являются источником свободного кислорода на Земле.
Во Вселенной кислород — третий по распространенности химический элемент после водорода и гелия.






