Загрязнение окружающей среды, присутствие в окружающей среде
Ванадий присутствует в растворе в океане очень слабо (от 1 до 3 мкг / л); например, 1,22 мкг / л в среднем в придонной воде залива Св. Лаврентия и 1,19 мкг / л в Северной Атлантике или от 1,2 до 1,8 мкг / л в Саргассовом море , 1, 53 до 2,03 мкг / л в Тихоокеанский. Она редко измеряется на прибрежной кайме , но несколько исследований обнаружили , что уровни в диапазоне от 0,61 μg.l -1 до 7,1 μg.l -1 на побережье Черного моря .
В воздухе или в воде это происходит в основном из-за вулканических выбросов , эрозии почв и горных пород или антропогенных источников, таких как сточные воды заводов, производящих оксид титана, которые содержат его много ( например: 317 т / год, принесенных Сеной в залива Сены ). В мире реки будут вносить в океан 312 000 т / год.
Загрязнение воздуха при сжигании углеводородного масла является еще одним источником; нефть сырая Кувейт или Саудовская Аравия в содержит, например , 29 до 60 мг на кг масла, вклад 12 000 до 24 000 т / год , из которых 10 до 15% достигают моря через дождь). Таким образом, более половины (53%) всего ванадия в воздухе имеет антропогенное происхождение.
Загрязнение почв и воды также локально в основном антропогенные; это имеет место в некоторых промышленных, горнодобывающих или нефтяных регионах мира. Большая часть ванадия, содержащегося в воде и экосистемах, поступает из углеводородов. В нефтяном коксе , который концентрированный ванадий на нефтеперерабатывающем заводе в выпуске в воду ( выщелачивание ) , чтобы экотоксикологический некоторую тревожная скорость (достижение порога экологической токсичности). Так обстоит дело в регионах добычи нефтеносных песков , особенно в регионе Атабаска (Альберта, Канада), которые содержат значительные количества ванадия. В этом регионе недавно (2017 г.) изучали фитопланктон и зоопланктон ; Schiffer & Liber показали, что ванадий в поверхностных водах достиг пороговых значений токсичности для фитопланктона и тем более для зоопланктона (который более чувствителен к нему). Эти две категории организмов составляют основу пищевой цепи в водной среде и пищевой сети .
Признаки нехватки ванадия
Так как организм человека требует крайне малых количеств этого микроэлемента, а содержание ванадия в составе различных продуктов достаточно высоко, нехватка минерала возникает достаточно редко.
У человека признаки недостатка ванадия не описаны. В экспериментах у лабораторных животных при скармливании им пищи, лишенной ванадия, у них замедлялся рост, ухудшалось состояние зубов, становились более хрупкими кости, повышался уровень холестерина в крови, страдала способность к размножению.
Установлена взаимосвязь между дефицитом ванадия и сахарным диабетом. При одновременном недостатке хрома и цинка риск диабета увеличивается еще больше.
Производство
Сублимированные в вакууме дендритные кристаллы ванадия (99,9%)
Кристаллы ванадия (99,9%), полученные электролизом
Кристаллический стержень ванадия с различной текстурой и окислением поверхности; 99,95% -чистый куб для сравнения
Металлический ванадий получают с помощью многоступенчатого процесса, который начинается с обжига измельченной руды с NaCl или Na 2 CO 3 при температуре около 850 ° C с получением метаванадата натрия (NaVO 3 ). Водный экстракт этого твердого вещества подкисляют с получением «красной лепешки», соли поливанадата, которая восстанавливается металлическим кальцием . В качестве альтернативы для мелкосерийного производства пентоксид ванадия восстанавливают водородом или магнием . Также используются многие другие методы, во всех из которых ванадий образуется как побочный продукт других процессов. Очистка ванадия возможна с помощью процесса кристаллического бруска, разработанного Антоном Эдуардом ван Аркелем и Яном Хендриком де Боером в 1925 году. Он включает образование иодида металла, в данном примере иодида ванадия (III) , и последующее разложение с получением чистого металла. :
- 2 В + 3 Я 2 ⇌ 2 ВИ 3
Куски феррованадия
Чаще всего ванадий используется в виде стального сплава под названием феррованадий . Феррованадий получают непосредственно восстановлением смеси оксида ванадия, оксидов железа и железа в электрической печи. Ванадий попадает в чугун, полученный из ванадийсодержащего магнетита. В зависимости от используемой руды в шлаке содержится до 25% ванадия.
Китай — крупнейший в мире производитель ванадия .
Химические свойства ванадия:
| 300 | Химические свойства | |
| 301 | Степени окисления | -3, -1, 0, +1, +2, +3, +4, +5 |
| 302 | Валентность | II, III, IV, V |
| 303 | Электроотрицательность | 1,63 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 650,91 кДж/моль (6,746187(21) эВ) |
| 305 | Электродный потенциал | V3+ + e— → V2+, Eo = -0,255,
V3+ + 3e— → V, Eo = -0,255, V2+ + 2e— → V, Eo = -0,255, |
| 306 | Энергия сродства атома к электрону | 50,6 кДж/моль |
5+V 4+V 3+V 2+V 1+V
V 01-V 2-V
Валентность V
Атомы ванадия в соединениях проявляют валентность V, IV, III, II, I.
Валентность ванадия характеризует способность атома V к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Валентность не имеет знака.
Квантовые числа V
Квантовые числа определяются последним электроном в конфигурации, для атома V эти числа имеют значение N = 3, L = 2, Ml = 0, Ms = ½
Соединения ванадия
Выше мы уже указывали на то, что как химический элемент данный металл проявляет достаточную активность, чтобы сформировать большое количество различных соединений. Так, известны следующие типы веществ с участием ванадия.
- Оксиды.
- Гидроксиды.
- Бинарные соли (хлориды, фториды, бромиды, сульфиды, йодиды).
- Оксисоединения (оксихлориды, оксибромиды, окситрифториды и прочие).
- Комплексные соли.

Так как валентность элемента варьируется достаточно широко, то и веществ получается немало. Главная отличительная особенность всех их — это окраска. Ванадий — химический элемент, разбор соединений которого показывает, что цвет может колебаться от белого и желтого до красного и синего, включая оттенки зеленого, оранжевого, черного и фиолетового. Отчасти именно это послужило причиной, по которой дали название атому, ведь это действительно выглядит очень красиво.
Однако многие из соединений получаются лишь при достаточно жестких условиях проведения реакции. Кроме того, большинство из них — токсичные, опасные для человека вещества. Агрегатное состояние веществ может быть самым разным. Например, хлориды, бромиды и фториды — чаще всего темно-розовые, зеленые или черные кристаллы. А оксиды — в виде порошков.
Галогениды ванадия
Кратко отметим, что единственный галогенид, отвечающий составу (ce{VHal5}), — это фторид (ce{VF5}). Максимально возможная степень окисления в хлориде и бромиде — +4, в иодиде — +3. Все галогениды ванадия в степенях окисления ниже максимально возможных получены, сводная таблица представлена на рисунке ниже:
В добавках для здоровья используют не просто ванадий, а производное от него вещество – сульфат ванадия. Именно он содержится в пище и усваивается организмом человека. Чистый элемент применяется в промышленной сфере. Сульфат ванадия представляет соединение соли ванадия и серной кислоты. Химическая формула – VSO4.
Свойства ванадия (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Ванадий |
| 102 | Прежнее название | |
| 103 | Латинское название | Vanadium |
| 104 | Английское название | Vanadium |
| 105 | Символ | V |
| 106 | Атомный номер (номер в таблице) | 23 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, переходный, чёрный металл |
| 109 | Открыт | Андрес Мануэль дель Рио Фернандез, Мексика, 1801 г., Нильс Габриэль Сефстрём, Швеция, 1830 г. |
| 110 | Год открытия | 1801 г. |
| 111 | Внешний вид и пр. | Пластичный металл серебристо-серого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,019 % |
| 120 | Содержание в морях и океанах (по массе) | 1,5·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0001 % |
| 122 | Содержание в Солнце (по массе) | 0,00004 % |
| 123 | Содержание в метеоритах (по массе) | 0,0061 % |
| 124 | Содержание в организме человека (по массе) | 3,0·10-6 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 50,9415(1) а. е. м. (г/моль) |
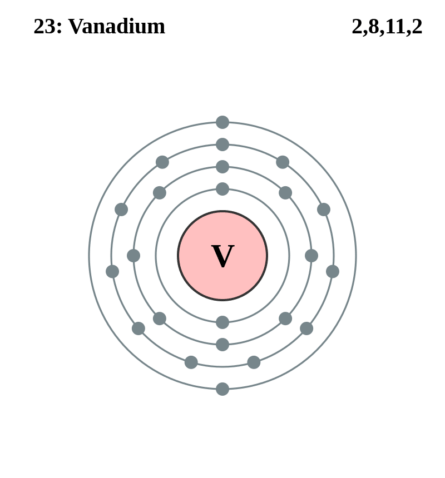
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d3 4s2 |
| 203 | Электронная оболочка |
K2 L8 M11 N2 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 171 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 153 пм |
| 207 | Радиус иона (кристаллический) | V 2+
93 (6) пм, V 3+ 78 (6) пм, V 4+ 72 (6) пм, V 5+ 68 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 23 электрона, 23 протона, 28 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 5-ая группа (по старой классификации – побочная подгруппа 5-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3, -1, 0, +1, +2, +3, +4, +5 |
| 302 | Валентность | II, III, IV, V |
| 303 | Электроотрицательность | 1,63 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 650,91 кДж/моль (6,746187(21) эВ) |
| 305 | Электродный потенциал | V3+ + e– → V2+, Eo = -0,255,
V3+ + 3e– → V, Eo = -0,255, V2+ + 2e– → V, Eo = -0,255, |
| 306 | Энергия сродства атома к электрону | 50,6 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 6,11 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело),
5,5 г/см3 (при температуре плавления 1910 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1910 °C (2183 K, 3470 °F) |
| 403 | Температура кипения* | 3407 °C (3680 K, 6165 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 21,5 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 444 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,502 Дж/г·K (при 20-100 °C) |
| 410 | Молярная теплоёмкость* | 24,89 Дж/(K·моль) |
| 411 | Молярный объём | 8,35 см³/моль |
| 412 | Теплопроводность | 30,7 Вт/(м·К) (при стандартных условиях),
30,7 Вт/(м·К) (при 300 K) |
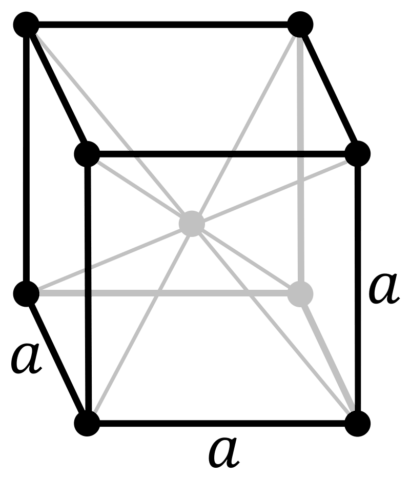
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки |
Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,024 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 390 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-62-2 |
Примечание:
205* Эмпирический радиус ванадия согласно и составляет 134 пм.
206* Ковалентный радиус ванадия согласно и составляет 153±8 пм и 122 пм соответственно.
401* Плотность ванадия согласно составляет 5,96 г/см3 (при 20 °C и при иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления ванадия согласно и составляет 1887 °C (2160 K, 3428,6 °F) и 1900 °C (2173,15 K, 3452 °F) соответственно.
403* Температура кипения ванадия согласно и составляет 3377 °C (3650 K, 6110,6 °F) и 3400 °C (3673,15 K, 6152 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) ванадия согласно и составляет 17,5 кДж/моль и 23 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) ванадия согласно и составляет 460 кДж/моль и 444,8 кДж/моль соответственно.
410* Молярная теплоемкость ванадия согласно составляет 24,95 Дж/(K·моль).
характеристики
Физические свойства
Кристаллическая структура ванадия, a = 302,4 пм
Ванадий — немагнитный, прочный, ковкий тяжелый металл синего цвета с плотностью 6,11 г / см 3 . Чистый ванадий относительно мягкий, но становится тверже при добавлении других элементов, и тогда он обладает высокой механической прочностью. По большинству свойств он похож на своего соседа по таблице Менделеева — титан . Температура плавления чистого ванадия составляет 1910 ° C, но она значительно увеличивается из- за примесей, таких как углерод . При содержании углерода 10% это около 2700 ° C. Ванадий кристаллизуется подобно хрому или ниобию в объемно-центрированной кубической кристаллической структуре с пространственной группой Im 3 m (пространственная группа № 229) и параметром решетки a = 302,4 пм, а также двумя формульными единицами на элементарную ячейку .
Ниже критической температуры 5,13 К ванадий становится сверхпроводником . Как и чистый ванадий, сплавы ванадия с галлием , ниобием и цирконием являются сверхпроводящими. При температурах ниже 5,13 К ванадий, как и металлы ванадиевой группы ниобий и тантал , проявляет крошечными кусочками до 200 атомов спонтанную электрическую поляризацию, которая еще не была объяснена, которая иначе проявляется только неметаллическими веществами .
Химические свойства
Ванадий является неблагородным металлом и может реагировать со многими неметаллами . В воздухе он неделями остается блестящим металлическим. Если смотреть в течение длительного периода времени, видна отчетливо видимая зеленая ржавчина. Если требуется консервация ванадия, его следует хранить в атмосфере аргона. В жару он подвергается действию кислорода и окисляется до оксида ванадия (V) . В то время как углерод и азот реагируют с ванадием только в раскаленном состоянии , реакция с фтором и хлором происходит на холоде.
По сравнению с кислотами и основаниями ванадий обычно стабилен при комнатной температуре из-за тонкого пассивирующего оксидного слоя; В этом состоянии он подвергается воздействию только фтористоводородной кислоты и сильно окисляющих кислот, таких как горячая азотная кислота , концентрированная серная кислота и царская водка .
Вплоть до температуры 500 ° С ванадием способен водородом к поглощению . Металл становится хрупким и легко измельчается. Водород можно удалить при 700 ° C в вакууме.
Crystal StructureHide
This section is currently hidden. Click the show button to view.
LoadUnit Cell |
Unit Cell Packed2x2x2 |
3x3x3 |
4x4x4
ShowBig Balls |
Small Balls |
Just Balls |
SpacefillPolyhedra Off |
Si Polyhedra |
All PolyhedraRemove metal-metal sticks
Display OptionsBlack Background |
White Background Perspective On |
Perspective Off2D |
Stereo |
Red-Blue |
Red-Cyan
ViewCIF File
Best |
x |
y |
z |
a |
b |
c
RotationStop |
Start
LabelsConsole
Off |
On |
Grey |
Yellow
Data courtesy of the American Mineralogist Crystal Structure Database. Click on an AMCSD ID to view structure
| ID | Species | Reference | Link | Year | Locality | Pressure (GPa) | Temp (K) |
|---|---|---|---|---|---|---|---|
| Vanadium | Wyckoff R W G (1963) Second edition. Interscience Publishers, New York, New York Body centered cubic, bcc, structure Crystal Structures 1 7-83 | 1963 | 293 | ||||
| Vanadium | Straumanis M E (1959) Absorption correction in precision determination of lattice parameters Journal of Applied Physics 30 1965-1969 | 1959 | synthetic | 293 | |||
| Vanadium | James W J, Straumanis M E (1960) Lattice parameter and expansion coefficient of vanadium Journal of the Electrochemical Society 107 69-69 | 1960 | synthetic | 293 | |||
| Vanadium | Hull A W (1922) Crystal structures of vanadium, germanium and graphite Physical Review 20 113-113 | 1922 | 293 |
CIF Raw Data — click here to closedata_global
_chemical_name_mineral ‘Vanadium’
loop_
_publ_author_name
‘Wyckoff R W G’
_journal_name_full ‘Crystal Structures’
_journal_volume 1
_journal_year 1963
_journal_page_first 7
_journal_page_last 83
_publ_section_title
;
Second edition. Interscience Publishers, New York, New York
Body centered cubic, bcc, structure
;
_database_code_amcsd 0011235
_chemical_formula_sum ‘V’
_cell_length_a 3.0240
_cell_length_b 3.0240
_cell_length_c 3.0240
_cell_angle_alpha 90
_cell_angle_beta 90
_cell_angle_gamma 90
_cell_volume 27.653
_exptl_crystal_density_diffrn 6.118
_symmetry_space_group_name_H-M ‘I m 3 m’
loop_
_space_group_symop_operation_xyz
‘x,y,z’
‘1/2+x,1/2+y,1/2+z’
‘z,-x,y’
‘1/2+z,1/2-x,1/2+y’
‘-y,z,-x’
‘1/2-y,1/2+z,1/2-x’
‘x,-y,z’
‘1/2+x,1/2-y,1/2+z’
‘-z,x,-y’
‘1/2-z,1/2+x,1/2-y’
‘y,-z,x’
‘1/2+y,1/2-z,1/2+x’
‘-x,y,-z’
‘1/2-x,1/2+y,1/2-z’
‘x,-z,-y’
‘1/2+x,1/2-z,1/2-y’
‘-z,y,x’
‘1/2-z,1/2+y,1/2+x’
‘y,-x,-z’
‘1/2+y,1/2-x,1/2-z’
‘-x,z,y’
‘1/2-x,1/2+z,1/2+y’
‘z,-y,-x’
‘1/2+z,1/2-y,1/2-x’
‘-y,x,z’
‘1/2-y,1/2+x,1/2+z’
‘x,z,y’
‘1/2+x,1/2+z,1/2+y’
‘-z,-y,-x’
‘1/2-z,1/2-y,1/2-x’
‘y,x,z’
‘1/2+y,1/2+x,1/2+z’
‘-x,-z,-y’
‘1/2-x,1/2-z,1/2-y’
‘z,y,x’
‘1/2+z,1/2+y,1/2+x’
‘-y,-x,-z’
‘1/2-y,1/2-x,1/2-z’
‘z,x,-y’
‘1/2+z,1/2+x,1/2-y’
‘-y,-z,x’
‘1/2-y,1/2-z,1/2+x’
‘x,y,-z’
‘1/2+x,1/2+y,1/2-z’
‘-z,-x,y’
‘1/2-z,1/2-x,1/2+y’
‘y,z,-x’
‘1/2+y,1/2+z,1/2-x’
‘-x,-y,z’
‘1/2-x,1/2-y,1/2+z’
‘-z,x,y’
‘1/2-z,1/2+x,1/2+y’
‘y,-z,-x’
‘1/2+y,1/2-z,1/2-x’
‘-x,y,z’
‘1/2-x,1/2+y,1/2+z’
‘z,-x,-y’
‘1/2+z,1/2-x,1/2-y’
‘-y,z,x’
‘1/2-y,1/2+z,1/2+x’
‘x,-y,-z’
‘1/2+x,1/2-y,1/2-z’
‘-x,z,-y’
‘1/2-x,1/2+z,1/2-y’
‘z,-y,x’
‘1/2+z,1/2-y,1/2+x’
‘-y,x,-z’
‘1/2-y,1/2+x,1/2-z’
‘x,-z,y’
‘1/2+x,1/2-z,1/2+y’
‘-z,y,-x’
‘1/2-z,1/2+y,1/2-x’
‘y,-x,z’
‘1/2+y,1/2-x,1/2+z’
‘-x,-z,y’
‘1/2-x,1/2-z,1/2+y’
‘z,y,-x’
‘1/2+z,1/2+y,1/2-x’
‘-y,-x,z’
‘1/2-y,1/2-x,1/2+z’
‘x,z,-y’
‘1/2+x,1/2+z,1/2-y’
‘-z,-y,x’
‘1/2-z,1/2-y,1/2+x’
‘y,x,-z’
‘1/2+y,1/2+x,1/2-z’
‘-z,-x,-y’
‘1/2-z,1/2-x,1/2-y’
‘y,z,x’
‘1/2+y,1/2+z,1/2+x’
‘-x,-y,-z’
‘1/2-x,1/2-y,1/2-z’
‘z,x,y’
‘1/2+z,1/2+x,1/2+y’
‘-y,-z,-x’
‘1/2-y,1/2-z,1/2-x’
loop_
_atom_site_label
_atom_site_fract_x
_atom_site_fract_y
_atom_site_fract_z
V 0.00000 0.00000 0.00000
Применение ванадия:
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
- https://en.wikipedia.org/wiki/Vanadium
- https://de.wikipedia.org/wiki/Vanadium
- https://ru.wikipedia.org/wiki/Ванадий
- http://chemister.ru/Database/properties.php?dbid=1&id=233
- https://chemicalstudy.ru/vanadiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: Фото https://www.pexels.com, https://pixabay.com
Найти что-нибудь еще?
карта сайта
ванадий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решеткаатом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома электронные формулы сколько атомов в молекуле ванадия сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
2 084
Операция
Схема ванадиевой проточной батареи
Батарея окислительно-восстановительного потенциала ванадия состоит из набора силовых элементов, в которых два электролита разделены протонообменной мембраной . Электроды в ячейке VRB сделаны на основе углерода; наиболее распространенными типами являются углеродный войлок, копировальная бумага, углеродная ткань и графитовый войлок. В последнее время электроды на основе углеродных нанотрубок вызвали заметный интерес со стороны научного сообщества. Оба электролитов являются ванадиевой основой, электролит в положительных полуэлементах содержит VO 2 + и VO 2+ ионы, электролит в отрицательных полуволнах клеток, V 3+ и V 2+ ионов. Электролиты могут быть получены любым из нескольких способов, включая электролитическое растворение пятиокиси ванадия (V 2 O 5 ) в серной кислоте (H 2 SO 4 ). Раствор остается сильно кислым при использовании.
В ванадиевых батареях оба полуэлемента дополнительно подключены к резервуарам для хранения и насосам, так что очень большие объемы электролитов могут циркулировать через элемент. Такая циркуляция жидких электролитов несколько затруднительна и ограничивает использование проточных ванадиевых батарей в мобильных приложениях, эффективно ограничивая их использование в крупных стационарных установках.
Когда ванадиевая батарея заряжается, ионы VO 2+ в положительном полуэлементе преобразуются в ионы VO 2 + , когда электроны удаляются с положительного вывода батареи. Аналогичным образом в отрицательную полуячейку вводятся электроны, преобразующие ионы V 3+ в V 2+ . Во время разряда этот процесс меняется на противоположный и приводит к типичному напряжению холостого хода 1,41 В при 25 ° C.
Половина реакции положительного электрода (катода) равна
- VO2++2ЧАС++е-↽—⇀VO2++ЧАС2О{\ Displaystyle {\ ce {VO2 + + 2H + + e- <=> VO ^ 2 + + H2O}}}
Полуреакция отрицательного электрода (анода) равна
- V2+↽—⇀V3++е-{\ displaystyle {\ ce {V ^ 2 + <=> V ^ 3 + + e ^ -}}}
Полная реакция (слева направо: разрядка, справа налево: зарядка)
- VO2++2ЧАС++V2+↽—⇀VO2++ЧАС2О+V3+{\ Displaystyle {\ ce {VO2 + + 2H + + V ^ 2 + <=> VO ^ 2 + + H2O + V ^ 3 +}}}
Обратите внимание, что протон должен переноситься через клеточную мембрану, когда электрон переносится между электродами, чтобы поддерживать нейтральность заряда.
Другими полезными свойствами проточных ванадиевых батарей являются их очень быстрая реакция на изменение нагрузки и их чрезвычайно большая перегрузочная способность. Исследования Университета Нового Южного Уэльса показали, что они могут достичь времени отклика менее половины миллисекунды при 100% изменении нагрузки и допускают перегрузки до 400% в течение 10 секунд. Время отклика в основном ограничено электрическим оборудованием. Если они специально не предназначены для более холодного или теплого климата, большинство ванадиевых батарей на основе серной кислоты работают только при температуре от 10 до 40 ° C. Ниже этого диапазона температур происходит кристаллизация серной кислоты, насыщенной ионами. Эффективность приема-передачи в практических приложениях составляет около 65–75%.
Предлагаемые улучшения
Ванадиевые окислительно-восстановительные батареи второго поколения ( ванадий / бром ) могут примерно удвоить плотность энергии и увеличить диапазон температур, в котором батарея может работать. Ванадий / бром и другие системы на основе ванадия также снизить стоимость ванадия окислительно — восстановительных батарей путем замены ванадия в положительном или отрицательном электролите более дешевыми альтернативами , такие как церий.
Характеристики
Редкий металл имеет следующие характеристики:
- Кристаллическая структура: кубическая объёмно-центрированная.
- Звукопроводность: 4560 м/с (при 20°C).
- Валентность ванадия: V (реже IV, III, II).
- Тепловое расширение: 8,4 мкм/(м·К) (при 25°С).
- Теплопроводность: 30,7 Вт/(м·К).
- Электрическое сопротивление: 197 nΩ·м (при 20°C).
- Магнетизм: парамагнитный.
- Магнитная восприимчивость: +255·10-6 см3/моль (298K).
- Модуль упругости: 128 ГПа.
- Модуль сдвига: 47 ГПа.
- Объёмный модуль упругости: 160 ГПа.
- Коэффициент Пуассона: 0,37.
- Твёрдость по шкале Мооса: 6,7.
- Твердость по Виккерсу: 628-640 МПа.
- Твердость по Бринеллю: 600-742 Мпа.
- Категория элемента: переходный металл.
- Электронная конфигурация: 3d3 4s2.
- Теплота плавления: 21,5 кДж/моль.
- Теплота испарения: 444 кДж/моль.
- Молярная теплоёмкость: 24,89 Дж/(моль·К).
Ванадий в таблице Менделеева находится в 5-й группе (подгруппа ванадия), 4-м периоде, d-блоке.
Характеристики
Кубоиды ванадия высокой чистоты (99,95%), переплавленные электронным пучком и макротравленные
Ванадий — это ковкий металл средней твердости, цвет голубой стали. Это электрический проводящее и термически изолирующий . Некоторые источники описывают ванадий как «мягкий», возможно потому, что он пластичный, пластичный и не хрупкий . Ванадий тверже, чем большинство металлов и сталей (см. Твердость элементов (страница данных) и ). Он имеет хорошую стойкость к коррозии и устойчив к щелочам и серной и соляной кислот . Он окисляется на воздухе при температуре около 933 К (660 ° C, 1220 ° F), хотя оксидный пассивирующий слой образуется даже при комнатной температуре.
Изотопы
Встречающиеся в природе ванадия состоит из одного стабильного изотопа , 51 V, и одного радиоактивного изотопа, 50 В. Последний имеет период полураспада 1,5 × 10 17 лет и естественное изобилие 0,25%. 51 В имеет ядерный спин из 7 / 2 , который является полезным для ЯМР — спектроскопии . Было охарактеризовано двадцать четыре искусственных радиоизотопа , в диапазоне массовых чисел от 40 до 65. Наиболее стабильными из этих изотопов являются 49 В с периодом полураспада 330 дней и 48 В с периодом полураспада 16,0 дней. Остальные радиоактивные изотопы имеют период полураспада менее часа, в большинстве случаев менее 10 секунд. По крайней мере четыре изотопа имеют метастабильные возбужденные состояния . Захват электронов является основным режимом распада для изотопов легче 51 В. Для более тяжелых изотопов наиболее распространенным режимом является бета-распад . Реакции электронного захвата приводят к образованию изотопов элемента 22 ( титан ), а бета-распад приводит к изотопам элемента 24 ( хром ).