Содержание в природе
Как самостоятельный элемент цинк в природе не встречается. Его можно добыть из 66 минералов, среди которых сфалерит, каламин, франклинит, цинкит, виллемит, смитсонит. Первый является наиболее распространенным источником металла, его часто называют «цинковой обманкой». Он состоит из сульфида цинка и примесей, которые придают минералу разнообразные цвета. Это осложняет его поиск и правильное определение.
Найти цинк можно в кислых и изверженных породах — во последних его немного больше. Часто металл в виде сульфида вместе со свинцом встречается в термальных водах, мигрирует в поверхностных и подземных источниках.
Содержание в природе
Цинк широко распространен в природе. Среднее содержание в земной коре составляет примерно 83 мг/кг, в поверхностных слоях почв – от 17 до 125 мг/кг. В породах цинк содержится в виде простого сульфида, а также замещает магний в силикатах.
В процессе выветривания минералов образуется подвижный двухвалентный металл. Он легко адсорбируется минералами и органическими соединениями.
В большей части типов почв цинк аккумулируется в поверхностных горизонтах и ассоциирует с гидроксидами железа, алюминия и глинистыми минералами.
В магматических породах распределен однородно. Наблюдается небольшое обогащение мафических пород (80–120 мг/кг) и слабое обеднение кислых пород (40–60 мг/кг).
Производство цинка
Как было сказано выше, чистого вида данного элемента в природе нет. Он добывается из иных пород, таких как руда – кадмий, галлий, минералы – сфалерит.
Металл получают на заводе. Каждый завод имеет свои отличительные особенности производства, поэтому оборудование для получения чистого материала различно. Оно может быть таким:
- Роторы, расположенные вертикально, электролитные.
- Специальные печи с достаточно высокой температурой для обжига, а также специальные электропечи.
- Транспортёры и ванны для электролиза.
https://youtube.com/watch?v=S1zo6SV3_SI
В зависимости от принимаемого метода добычи металла, задействовано соответствующее оборудование.
Сырье для получения цинка
Основным источником получения цинка являются сульфидные, медно-свинцово-цинковые, медно-цинковые и свинцово-цинковые руды.
В сульфидных рудах цинк обычно присутствует в виде сфалерита или вуртцита, состав которых отвечает формуле ZnS, и марматита nZnS · mFeS. Спутниками цинка в полиметаллических рудах являются минералы и элементы.
В окисленных зонах месторождений цинксодержащих руд основными кислородсодержащими минералами цинка являются: смитсонит ZnCO3, цинкит ZnO и каламин ZnO·SiO2 ·H2O. Окисленные цинковые руды в настоящее время имеют подчиненное значение.
В сульфидных полиметаллических рудах содержание цинка обычно составляет 1…3 %. Эти руды имеют сложный состав. Все это обусловливает необходимость проведения предварительного обогащения руд по селективной схеме с получением нескольких концентратов.
Цинковые концентраты селективного флотационного обогащения полиметаллических руд содержат, %: Zn – 48…60; Pb – 1,5…2,5; Cu – 1…3; Cd – до 0,25; Fe – 3…10; S – 30…38, пустой породы – до 10.
Цинковые концентраты – комплексное дорогостоящее сырьё. Из них нужно извлекать цинк, свинец, медь, кадмий, серу, золото, серебро, ртуть, галлий, индий, таллий, селен, теллур и др.
Иногда при обогащении труднообогатимых медно-цинковых руд получают промежуточные продукты, содержащие 12…18 % Zn и 4…8 % Cu. Переработка этих материалов затруднена как на цинковых, так и на медных заводах.
Переработку цинковых концентратов в настоящее время осуществляют двумя методами – пирометаллургическим и гидрометаллургическим.
В основе пирометаллургического способа лежит процесс восстановления оксида цинка при 1000…1100 ºС, т. е. при температуре выше точки кипения металлического цинка, что обеспечивает выделение его в момент образования в парообразном состоянии и возгонку в виде паров:
ZnO + C = Znпар + CO; ZnO + CO = Znпар + CO2.
Пары цинка в дальнейшем конденсируют. Получение жидкого цинка дистилляцией возможно только в условиях сильно восстановительной атмосферы и полной герметизации применяемой аппаратуры.
В связи с тем что цинковый концентрат представляет собой сульфидный материал, а восстановление цинка возможно только из его оксида, дистилляции предшествует окислительный обжиг с полным удалением серы.
Возможны несколько вариантов аппаратурного оформления пирометаллургического способа получения цинка: в горизонтальных и вертикальных ретортах, в шахтных и электрических печах. Принцип действия положен в основу получения паров цинка в электротермической части кивцетного агрегата.
Получающийся пирометаллургическим способом цинк обязательно содержит большое количество металлов-примесей, возгоняемых вместе с ним или попадающих в него из выносимой газами пыли. Поэтому дистилляционный цинк, как и всякий черновой металл, нуждается в рафинировании.
Пирометаллургический способ применяют с момента возникновения цинкового производства. Доля выпуска цинка этим способом из года в год сокращается и в настоящее время составляет не более 20 %.
Гидрометаллургический способ является в настоящее время основным. Широкое распространение гидрометаллургии при производстве цинка обусловлено ее значительными преимуществами по сравнению с дистилляцией. К ним относятся:
- извлечение большего количества цинка и сопутствующих элементов;
- большая комплексность использования сырья;
- высокое качество цинка;
- высокая механизация трудоемких процессов.
По этому способу цинк выщелачивают раствором серной кислоты из предварительно обожженного концентрата. При выщелачивании цинк переходит в раствор в виде сернокислого цинка по реакции
ZnO + H2SO4 = ZnSO4 + H2O.
При выщелачивании цинкового огарка в раствор частично переходят содержащиеся в нем компоненты. Качество получаемого электролитическим осаждением цинка зависит от чистоты раствора: чем чище раствор, поступающий на электролиз, тем более чистым получается товарный цинк. Поэтому перед электролизом раствор тщательно очищают от примесей.
Процесс электролитического осаждения цинка из очищенного раствора протекает по следующей суммарной реакции:
ZnSO4 + H2O = Zn + H2SO4 + 0,5O2
Цинк при электролизе осаждается на катоде, а на аноде регенерируется серная кислота, необходимая для выщелачивания свежих порций огарка, и выделяется кислород. Катодные осадки цинка переплавляют и разливают в слитки.
Кек (нерастворенный осадок), получаемый после выщелачивания, подвергают дополнительной переработке с целью доизвлечения из него цинка и других ценных компонентов.
Как примеси изменяют свойства цинка
Производители ограничивают содержание кадмия, олова и свинца в литейных сплавах цинка, чтобы подавить межкристаллитную коррозию.
Олово — вредная примесь. Металл не растворяется и выделяется из расплава — способствует ломкости цинковых отливок. Кадмий напротив — растворяется в цинке и снижает его пластичность в горячем состоянии. Свинец увеличивает растворимость металла в кислотной среде.
Железо повышает твердость цинка, но снижает его прочность. Вместе с тем оно усложняет процесс заполнения форм при литье.
Медь увеличивает твердость цинка, но уменьшает его пластичность и стойкость при коррозии. Содержание меди также мешает рекристаллизации цинка.
Наиболее вредная примесь — мышьяк. Даже при небольшом ее количестве металл становится хрупким и менее пластичным.
Чтобы избежать растрескивания кромок при горячей прокатке цинка, содержание сурьмы не должна быть выше 0,01%. В горячем состоянии она увеличивает твердость цинка, лишая его хорошей пластичности.
Цинк АП, Таблетки
Состав
1 таблетка содержит:
Активные компоненты: цинк (в форме цинка цитрата) — не менее 10.2 мг, аскорбиновая кислота (витамин С) — не менее 76.5 мг.
Вспомогательные компоненты: МКЦ, магния стеарат, крахмал картофельный.
Фармакологические свойства
Цинк АП — биологически активная добавка (БАД) к пище, источник цинка. Создан для качественного восполнения дефицита цинка в организме. В состав входит цитрат цинка — один из лучших с позиции биодоступности источников цинка.
Цинк — один из наиболее важных микроэлементов для организма человека. Являясь единственным металлом, представленным в каждом классе ферментов, цинк не может быть заменен никаким другим металлом.
Цинк принимает непосредственное участие в таких жизненно важных процессах, как регуляция жирового и углеводного обмена, ускоряет заживление ран, необходим для правильного развития мозга и нормальной работы нервных клеток, стимулирует иммунитет, повышая сопротивляемость организма в период простудных заболеваний.
Цинк активно участвует в процессе регенерации и обновления кожи, регулирует работу сальных желез, стимулирует синтез коллагена и кератина, влияя на рост волос и ногтей.
Проявляя антиоксидантные свойства, цинк способствует замедлению процессов клеточного старения.
Цинк является ключевым с точки зрения репродуктивного здоровья микроэлементом. Он оказывает значительное влияние на выработку мужских и женских половых гормонов, влияя тем самым на репродуктивную функцию и сексуальную активность.
Недостаточное потребление цинка приводит к циррозу печени, половой дисфункции, вторичному иммунодефициту, анемии, наличию пороков развития плода. С возрастным дефицитом цинка связывают развитие артериальной гипертензии и вторичного иммунодефицита, атрофические изменения во всех органах и системах, развитие импотенции.
Показания
Цинк АП применяется в качестве биологически активной добавки к пище — дополнительного источника витамина С и цинка:
— для снятия симптомов и профилактики заболеваний, связанных с дефицитом цинка;
— для укрепление иммунитета;
— для улучшения состояния кожи, волос и ногтей;
— для ускорения заживления ран;
— для улучшения функционального состояния репродуктивной системы;
— для повышения антиоксидантного статуса организма.
Способ применения и дозы
Таблетки Цинк АП принимают внутрь, во время еды.
Взрослым: по 1 таблетке 1 — 2 раза в день.
Продолжительность приёма — 1 месяц.
Особые указания и меры предосторожности
Цинк АП — биологически активная добавка к пище. Не является лекарством.
Перед применением рекомендуется проконсультироваться с врачом.
Теплопроводность стали, меди, алюминия, никеля и их сплавов
Обычное железо и цветные металлы имеют разное строение молекул и атомов. Это позволяет им отличаться друг от друга не только механическими, но и свойствами теплопроводности, что, в свою очередь, влияет на применение тех или иных металлов в различных отраслях хозяйства.
Таблица 2
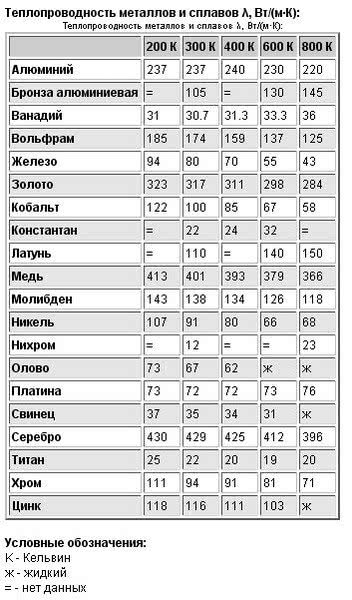
Сталь имеет коэффициент теплопроводности, при температуре окружающей среды 0 град. (С), равный 63, а при увеличении градуса до 600, он снижается до 21 Вт/м*град. Алюминий, в таких же условиях, наоборот – увеличит значение от 202 до 422 Вт/м*град. Сплавы из алюминия, будут также повышать теплопроводность, по мере увеличения температуры. Только величина коэффициента будет на порядок ниже, в зависимости от количества примесей, и колебаться в пределах от 100 до 180 единиц.
Медь, при изменении температуры в тех же пределах, будет уменьшать теплопроводность от 393 до 354 Вт/м*град. При этом, медь содержащие сплавы латуни будут иметь такие же свойства, как и алюминиевые, а значение теплопроводности будет изменяться от 100 до 200 единиц, в зависимости от количества цинка и других примесей в составе сплава латуни.
Коэффициент теплопроводности чистого никеля считается низким, он будет менять свое значение от 67 до 57 Вт/м*град. Сплавы с содержанием никеля, будут также иметь коэффициент с пониженным значением, который, благодаря содержанию железа и цинка, колеблется от 20 до 50 Вт/м*град. А наличие хрома, позволит понизить теплопроводность в металлах до 12 единиц, с небольшим увеличением этой величины, при нагреве.
ПРИМЕНЕНИЕ
 Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах.
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Цинк (англ. Zinc) — Zn
| Молекулярный вес | 65.39 г/моль |
| Происхождение названия | Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium II |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Применение
В нынешнее время применение сплавов цинка с другими металлами можно увидеть в различных отраслях производства.
Для защиты металлов от коррозии
Чтобы защитить другие металлы от развития коррозии, используется чистый материал, которым покрывается уязвимая поверхность. Процесс покрытия называется металлизация.
В автомобильной отрасли
Цинк и сплавы с его добавлением получили большую популярность в автомобильной отрасли. Смеси металлов используют для декоративного покрытия отдельных элементов автомобиля (ручки, бампера, решетки, зеркала). Зубчатые механизмы, рычажные механизмы, покрышки, аккумуляторах — содержат это вещество.
В производстве ювелирных украшений
Бижутерия и украшения из цинковых сплавов известны уже длительное время. Цинк часто смешивается с золотом. Для изготовления белого золота также используют этот металл. Он осветляет готовое изделие.
В строительстве
В строительстве широкое применение получили сплавы из цинка и других металлов. Например, их используют при производстве кровли. Из оцинковки изготавливается не только кровельное покрытие, но и различные трубы, желоба, ветровые планки, подшивка для свесов крыши.
В медицине
Если говорить о медицине, окись цинка часто используется в качестве антисептического средства. Также ее добавляют в составы использующиеся для ускорения регенерации.

Применение цинка в медицине
Строительство
Контейнер цинк-угольного сухого элемента представляет собой цинковую банку (анод). Банка содержит слой водной пасты NH 4 Cl или ZnCl 2, пропитывающий слой бумаги, который отделяет цинковую банку от смеси порошкообразного углерода (обычно графитового порошка) и оксида марганца (IV) ( MnO 2 ), который упакован вокруг угольный стержень. Углерод является единственным практичным проводящим материалом, потому что каждый обычный металл в положительном электроде в солевом электролите быстро корродирует .
Поперечное сечение угольно-цинковой батареи
Ранние типы и недорогие ячейки используют сепаратор, состоящий из слоя крахмала или муки . В современных ячейках используется слой бумаги с крахмальным покрытием, который тоньше и позволяет использовать больше диоксида марганца. Первоначально ячейки были заделаны слоем асфальта, чтобы предотвратить высыхание электролита; в последнее время применяется термопластичный герметик для шайб. Углеродный стержень слегка пористый, что позволяет улетучиваться накопившемуся газообразному водороду , сохраняя при этом водный электролит. Соотношение диоксида марганца и углеродного порошка в катодной пасте влияет на характеристики элемента: большее количество углеродного порошка снижает внутреннее сопротивление , а большее количество диоксида марганца улучшает накопительную способность.
Плоские элементы предназначены для сборки в батареи с более высоким напряжением, примерно до 450 вольт. Плоские элементы уложены друг на друга, и вся сборка покрыта воском для предотвращения испарения электролита . Электроны текут от анода к катоду через провод присоединенного устройства.
Атом и молекула цинка. Формула цинка. Строение атома цинка:
Цинк (лат. Zincum, от нем. Zinke – «зубец») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Zn и атомным номером 30. Расположен в 12-й группе (по старой классификации – побочной подгруппе второй группы), четвертом периоде периодической системы.
https://youtube.com/watch?v=McEmVMSY44Y
Цинк – амфотерный металл. Относится к группе переходных металлов. Относится к цветным металлам.
Цинк обозначается символом Zn.
Как простое вещество цинк при нормальных условиях представляет собой хрупкий металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
Молекула цинка одноатомна.
Химическая формула цинка Zn.
Электронная конфигурация атома цинка 1s2 2s2 2p6 3s2 3p6 3d10 4s2. Потенциал ионизации (первый электрон) атома цинка равен 906,4 кДж/моль (9,394197(6) эВ).
Строение атома цинка. Атом цинка состоит из положительно заряженного ядра (+30), вокруг которого по четырем оболочкам движутся 30 электронов. При этом 28 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку цинк расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома цинка – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома цинка состоит из 30 протонов и 35 нейтронов.
Радиус атома цинка (вычисленный) составляет 142 пм.
Атомная масса атома цинка составляет 65,38(2) а. е. м.
Цинк с давних пор широко используется человеком.
Взаимодействие цинка с другими веществами
- Прием витаминов А, E, C, В6, фтор, пиколиновая кислота улучшают усваивание организмом Zn;
- Большие дозы витамина В9, железа, олова, меди, свинца, кадмия, кальция, марганца, селена и ртути препятствуют усвоение организмом Zn;
- Нарушению усвоения Zn также могут способствовать поступление следующих веществ – фосфаты, фитаты, диуретики, глюкокортикостероиды, анаболики, алкоголь, иммуносупрессоры, противозачаточные препараты, танины (чай и кофе);
- Повышенное поступление Zn может способствовать недостатку витамина А, а также меди и железа;
- Полноценное снабжение Zn способствует нормальному усвоению витамина E.
Нехватка цинка — симптомы
Дефицит цинка в организме выражается следующими симптомами и состояниями:
- У мужчин — нарушение работы половых желез, развитие бесплодия, задержка полового развития;
- У женщин — нарушение менструальной функции и работы яичников, бесплодие;
- Повышенная утомляемость, слабость;
- Медленное заживление ран;
- Частые аллергии на различные вещества;
- Ухудшение здоровья кожи, волос, ногтей;
- Снижение настроения, склонность к депрессии, уязвимость перед стрессами;
- Нарушение функции кроветворения – анемии;
- Ухудшение зрительной функции;
- Предрасположенность к инфекциям, кожным болезням (дерматиты, фурункулы, псориаз), неврологическим расстройствам, онкологии;
- Снижение аппетита, диарея, потеря веса;
- Ранее старение.
Причины нехватки Zn
- Некачественное питание, жесткие диеты, голодовка;
- Злоупотребление алкоголем;
- Наличие глистных инвазий в кишечнике;
- Отравление организма медью, ртутью, свинцом, кадмием;
- Повышенные дозировки некоторых лекарственных препаратов – диуретиков (мочегонные), глюкокортикостероидов (гормоны), эстрогенов;
Амфотерный характер гидроксида цинка
Белый осадок, выпадающий под действием щелочи на растворы солей металла – это основание цинка. Соединение быстро растворяется под действием кислот или щелочей. Первый тип реакции заканчивается образованием средних солей, второй – цинкатов. В твердом виде выделены комплексные соли – гидроксоцинкаты. Особенностью гидроксида цинка является его способность растворяться в водном растворе аммиака с образованием гидроксида тетраамминцинка и воды. Основание цинка является слабым электролитом, поэтому как его средние соли, так и цинкаты в водных растворах поддаются гидролизу, то есть их ионы взаимодействуют с водой и образуют молекулы гидроксида цинка. Растворы таких солей металла, как хлорид или нитрат, будут иметь кислую реакцию вследствие накопления избытка ионов водорода.
Свойства сплавов цинка
Чтобы понимать какими свойствами должны обладать цинковые сплавы, необходимо знать характеристики цинка. Литейные качества, температура плавления, твердость и другие параметры этого соединения зависят от химических и физических свойств цинка. Он представляет собой голубоватый металл. Это вещество не встречается в природных месторождениях в чистом виде. В процессе длительной обработки получается оксид цинка, из которого можно получить чистый металл.
Характеристики и свойства цинка
Перед описанием сплавов цинка и их применения в различных направлениях производства требуется разобраться со свойствами цинка.
Химические свойства:
- При длительном нагревании может вступать в реакции с Н2О и сероводородом. В ее процессе выделяется водород.
- Не вступает в контакт с углеродом и азотом.
- Смешивается с различными неметаллами — кислородом, фосфором и серой.
- При соединении с щелочами, образуются цинкаты (это соли цинковой кислоты).
- Если смешивать металл с серной кислотой, могут образовываться различные вещества. Все зависит от количества кислоты.
- При очень высокой температуре металл может контактировать с различными газами (йод в газообразном состоянии, хлор и фтор).
Физические свойства:
- Представляет собой прочный металл. При нагревании до 100–150°С он становится пластичным. При разогревании более 210 °С металл изменяет свою форму. В сравнении с другими металлами цинк плавится при низкой температуре.
- Обладает хорошей теплопроводностью — 116 Вт/м К.
- Кипение материала при температуре — 906°С.
- Плотность — 7.133 гр./см куб.
- Плавление материала — 419°С.
- Максимальная прочность при растяжении — 200–250 МН/м2.
- Удельная теплота испарения — 114.8 КДж/моль.
Количество примесей в составе металла напрямую зависит от способа добычи, обработки и изначальной породы материала. Часто встречающиеся примеси, содержащиеся в цинке — никель, фтор, хлор и свинец.

Необработанный металл
Как примеси изменяют свойства цинка
Посторонние примеси, содержащиеся в цинке, ухудшают характеристики этого металла (при большом содержании). Первостепенная задача производителей — снизить количество свинца, кадмия и олова в этом металле, чтобы избежать межкристаллической коррозии.
Воздействие примесей на цинк:
- Свинец — усиливает растворимость металла в воде.
- Медь — ухудшает показатель пластичности. Металл становится более уязвимым для коррозии, однако улучшается его прочность.
- Мышьяк — ухудшает прочность и пластичность цинка даже при минимальном содержании.
- Олово — увеличивает ломкость готовых отливок.
- Кадмий — снижает пластичность металла.
- Сурьма — в процессе прокатки при больших температурах, увеличивает прочность и ухудшает пластичность цинка.
Практически все примеси считаются вредными для готовых заготовок. Из-за этого производители в первую очередь проводят ряд процедур, чтобы содержание цинка в готовой отливке было наиболее высоким.
Получение чистого цинка
Как упоминалось выше – в природе чистого вида нет. В основном добыча производится из руд, в которых он идет с различными элементами.
Для получения чистого материала задействован специальный флотационный процесс с избирательностью (селективностью). После проведения процесса руда распадается на элементы: цинк, свинец, медь и так далее.
Добытый таким методом чистый металл обжигается в специальной печи. Там при определенных температурах сульфидное состояние материала переходит в оксидное. При обжиге выделяется газ с содержанием серы, направляемый для получения серной кислоты.

Чистый цинк
Есть 2 способа получения металла:
- Пирометаллургический – идет процесс обжигания, после — полученная масса восстанавливается с помощью чёрного угля и кокса. Конечным процессом является отстаивание.
- Электролитический – добытая масса обрабатывается серной кислотой. Полученный раствор подвергают электролизу, при этом металл оседает, его плавят в печах.
Где применяется
Свойства металла, его сплавов, соединений обусловили их использование в металлургии, электротехнике, медицине.
Чистый металл
Основные направления:
- Отрицательный электрод батареек, аккумуляторов.
- Восстановитель благородных металлов.
- Защитное покрытие стали от коррозии.
- Компонент твердых припоев для повышения легкоплавкости.
- Извлекатель металлов из чернового свинца.
До середины XX века популярной сферой применения цинка была полиграфия. Для создания черно-белых иллюстраций в газетах или книгах использовался метод цинкографии. На цинковой пластине кислотой вытравливалось изображение. Затем с нее на печатной машине делались оттиски.
 Слитки цинка
Слитки цинка
Сплавы
Цинк востребован как компонент сплавов с металлами. Например, латуни.
Она используется машиностроителями для точного литья:
- Автомобильная фурнитура.
- Оболочка карбюраторной коробки.
- Затворы травматических пистолетов.
Соединения
Применение нашли соединения металла, созданные природой или человеком:
- Хлорид – паяние металлов, изготовление фибры.
- Теллурид, селенид, фосфит – полупроводники.
- Селенид задействован при изготовлении специальных сортов стекла для лазеров.
- Окись – исходник для цинковых белил.
- Сульфид – компонент люминофоров (гибкие панели, экраны).
Фосфитом металла изничтожают грызунов.