производство
Ниже приведены некоторые способы получения этого соединения:
-Большая часть бензойной кислоты производится в промышленности путем окисления толуола кислородом, присутствующим в воздухе. Процесс катализируется нафтенатом кобальта при температуре 140-160 ° С и давлении 0,2-0,3 МПа..
-Толуол, с другой стороны, может быть хлорирован для получения бензотрихлорида, который впоследствии гидролизуется до бензойной кислоты.
-Гидролиз бензонитрила и бензамида в кислой или щелочной среде может привести к образованию бензойной кислоты и ее сопряженных оснований.
-Бензиловый спирт при окислении, опосредованном перманганатом калия, в водной среде образует бензойную кислоту. Реакция происходит при нагревании или дефлегмации. После завершения процесса смесь фильтруют для удаления диоксида марганца, а надосадочную жидкость охлаждают до получения бензойной кислоты..
-Бензотрихлоридное соединение реагирует с гидроксидом кальция, используя железо или соли железа в качестве катализаторов, первоначально образуя бензоат кальция, Са (С6H5COO)2. Затем эта соль по реакции с соляной кислотой превращается в бензойную кислоту..
Реакции [ править ]
Реакции бензойной кислоты могут протекать либо по ароматическому кольцу, либо по карбоксильной группе
Ароматическое кольцо править
Реакция электрофильного ароматического замещения будет происходить в основном в 3-м положении из-за электроноакцепторной карбоксильной группы ; т.е. бензойная кислота является .
Карбоксильная группа править
Реакции, характерные для карбоновых кислот, распространяются и на бензойную кислоту.
- Сложные эфиры бензоата являются продуктом катализируемой кислотой реакции со спиртами .
- Амиды бензойной кислоты обычно получают из бензоилхлорида .
- Дегидратация до бензойного ангидрида индуцируется уксусным ангидридом или пентоксидом фосфора .
- Производные кислот с высокой реакционной способностью, такие как галогенангидриды , легко получить путем смешивания с галогенирующими агентами, такими как хлориды фосфора или тионилхлорид .
- Ортоэфиры могут быть получены реакцией спиртов в кислых безводных условиях с бензонитрилом .
- Восстановление до бензальдегида и бензилового спирта возможно с использованием DIBAL-H , LiAlH 4 или боргидрида натрия .
- Декарбоксилирование до бензола можно осуществить нагреванием в хинолине в присутствии солей меди. Декарбоксилирование Хунсдикера может быть достигнуто путем нагревания соли серебра.
Функции кислот
Кислоты в косметических средствах выполняют разные функции. Молочная отшелушивает ороговевшие чешуйки, придавая коже гладкость и мягкость. Лимонная отбеливает, натуральные АНА и ВНА увлажняют. Органические кислоты для сохранности продукта сочетают с консервантами. Чем ниже значение ph (показатель кислотности), тем больше срок использования крема.
Чего ожидать от крема или шампуня, у которого в составе есть benzoic acid? В косметике он выполняет роль консерванта. Известно, что бензойная кислота содержится в ягодах брусники. Именно ей знаменитая ягода обязана свойством воздействовать на инфекцию в почках. Она же образуется в кисломолочных ферментированных продуктах.
На этом основании синтетическую бензойную кислоту применяют в производстве натуральных средств для кожи. Некоторые марки спокойно указывают ее в составе, не боясь укоров в недобросовестности.
Технологи объясняют это двумя причинами: во-первых, использовать ценное органическое сырье на производство консервантов расточительно, его забирает пищевая промышленность.
Во-вторых, бензойная кислота и ее производное Sodium Benzoate (Е211) разрешены экостандартами и поэтому считаются органическими консервантами. В последнее время больше внимания уделяют Е211, поскольку он, в отличие от Е210, не проникает через мембрану клетки.
Применение
Калориметрия
Бензойная кислота используется как вещество в качестве теплового стандарта для калибровки калориметров по температуре и теплоёмкости, так как теплота кристаллизации и плавления хорошо известны и воспроизводимы.
Сырьё
Бензойная кислота служит для получения многих реактивов, наиболее значимые из них:
Бензоилхлорид, C6H5C(O)Cl, получается обработкой бензойной кислоты тионилхлоридом, фосгеном или хлоридами фосфора PCl3 и PCl5
C6H5C(O)Cl — важное исходное вещество для некоторых производных бензойной кислоты, таких как бензилбензоат, используемый как искусственный ароматизатор и репеллент.
Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры, получаемые переэтерефикацией метилбензоата с соответствующим диолом. Альтернативно эти вещества получаются действием бензоилхлорида на соответствующий диол
Эти пластификаторы используются с соответствующими эфирами терефталевой кислоты.
Фенол, C6H5OH, получаемый окислительным декарбоксилированием при 300—400 °C. Необходимая температура может быть понижена до 200 °C добавлением каталитических количеств солей меди (II). Далее фенол может быть конвертирован в циклогексанол, который служит исходным веществом в синтезе нейлона.
Консервант
Бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213).
Бензойная кислота, блокируя ферменты, замедляет обмен веществ во многих одноклеточных микроорганизмах и грибках. Она подавляет рост плесени, дрожжей и некоторых бактерий.
В пищевые продукты её добавляют в чистом виде или в виде натриевой, калиевой или кальциевой соли.
Губительное действие на микрофлору начинается с абсорбции бензойной кислоты липидной стенкой клетки.
Поскольку через стенку клетки может проникнуть только недиссоциированная кислота, бензойная кислота проявляет антимикробное действие только в кислых пищевых продуктах.
Если внутриклеточный pH 5 или меньше, анаэробная ферментация глюкозы через фосфорфруктокиназу уменьшается на 95 %. Эффективность бензойной кислоты и бензоатов зависит от кислотности (pH) пищи.
Кислая пища, напитки, такие, как фруктовые соки, (содержащие лимонную кислоту), газированные напитки, содержащие в растворе (углекислый газ), безалкогольные напитки с (фосфорной кислотой), соленья (молочная кислота) и другие кислые пищевые продукты консервируются бензойной кислотой и её солями.
Принятые и оптимальные концентрации бензойной кислоты при консервации пищи 0,05—0,1 %.
Медицина
Бензойную кислоту применяют в медицине при кожных заболеваниях, как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, при трихофитиях и микозах, а её натриевую соль, — бензоат натрия — как отхаркивающее средство.
Другие применения
Эфиры бензойной кислоты (со спиртами от метилового до амилового) обладают сильным и приятным запахом и применяются в парфюмерной промышленности.
Некоторые другие производные бензойной кислоты, такие как, например, хлор- и нитробензойные кислоты, широко применяются для синтеза красителей.
описание
Бензойную кислоту можно получить из бромбензола с помощью реакции Гриньяра . Бромбензол реагирует с магнием с образованием бромида фенилмагния , который реагирует с диоксидом углерода с образованием C 6 H 5 COOMgBr и, наконец, бензойной кислоты при добавлении раствора соляной кислоты.
Кроме того, бензойная кислота может быть получена путем карбоксилирования из бензола с помощью фосгена и трихлорида алюминия (AlCl 3 ) может быть представлено в качестве катализатора. Эта реакция состоит из ацилирования Фриделя-Крафтса и последующего гидролиза промежуточного бензоилхлорида :
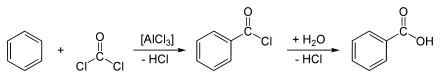
Технически, толуол окисляются с марганцевым диоксидом и серной кислотой в присутствии нафтената марганец , или путем реакции с перманганатом калия . Сегодня толуол в промышленных масштабах окисляется кислородом в газовой фазе в присутствии катализаторов, таких как пятиокись ванадия .
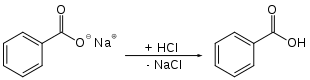
В лаборатории бензойную кислоту можно синтезировать из бензоата натрия. В присутствии соляной кислоты бензоат натрия реагирует с образованием бензойной кислоты и хлорида натрия:
Структура бензойной кислоты
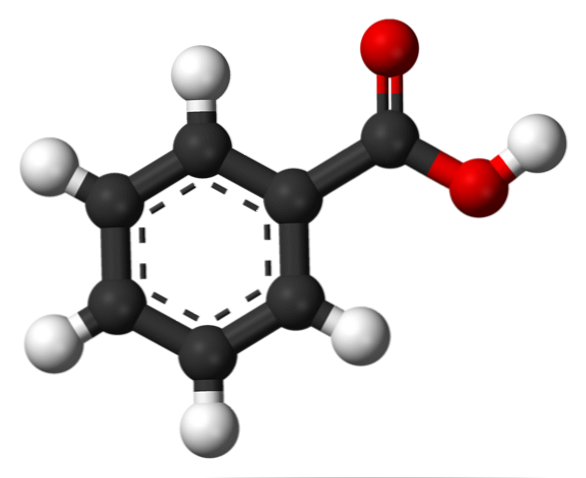
На верхнем изображении структура бензойной кислоты представлена в виде стержня и сферы. Если подсчитать количество черных сфер, то будет проверено, что их шесть, то есть шесть атомов углерода; две красные сферы соответствуют двум атомам кислорода карбоксильной группы -COOH; и, наконец, белые сферы являются атомами водорода.
Как видно, ароматическое кольцо слева, ароматичность которого показана пунктирными линиями в центре кольца. А справа группа -COOH, ответственная за кислотные свойства этого соединения.
Молекулярно, С6H5COOH имеет плоскую структуру, потому что все его атомы (кроме водорода) имеют sp-гибридизацию2.
С другой стороны, группа -COOH, очень полярная, позволяет постоянному диполю существовать в структуре; диполь, который можно наблюдать с первого взгляда, если доступна его карта электростатического потенциала.
Этот факт как следствие того, что C6H5COOH может взаимодействовать с самим собой диполь-дипольными силами; в частности, со специальными водородными мостиками.
Если наблюдается группа -COOH, будет обнаружено, что кислород C = O может принимать водородную связь; в то время как кислород O-H дарит им.
Хрустальные и водородные мосты
Бензойная кислота может образовывать две водородные связи: она получает и принимает одну одновременно. Следовательно, он образует димеры; то есть его молекула «связана» с другим.
Являются ли эти пары или димеры, C6H5COOH-HOOCC6H5, структурная основа, которая определяет твердое тело в результате его упорядочения в пространстве.
Эти димеры образуют плоскость молекул, которые, благодаря своим сильным и направленным взаимодействиям, способны установить упорядоченную структуру в твердом теле. Ароматические кольца также участвуют в этой договоренности через взаимодействия дисперсионных сил.
В результате молекулы образуют моноклинный кристалл, точные структурные характеристики которого можно изучить с помощью инструментальных методов, таких как дифракция рентгеновских лучей..
Тогда пара плоских молекул может быть размещена в пространстве преимущественно водородными связями, чтобы вызвать появление этих белых и кристаллических игл..
Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
|
Например.
Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол |
| Изопропилбензол | Пропилбензол |
Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
|
Например.
Формуле С9Н12 соответствуют изомеру изопропилбензол и пропилбензол |
| Изопропилбензол | Пропилбензол |
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
| Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму |
| Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца. |
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
Применение
Калориметрия
Бензойная кислота используется как вещество в качестве теплового стандарта для калибровки калориметров по температуре и теплоёмкости, так как теплота кристаллизации и плавления хорошо известны и воспроизводимы.
Сырьё
Бензойная кислота служит для получения многих реактивов, наиболее значимые из них:
Бензоилхлорид, C6H5C(O)Cl, получается обработкой бензойной кислоты тионилхлоридом, фосгеном или хлоридами фосфора PCl3 и PCl5
C6H5C(O)Cl — важное исходное вещество для некоторых производных бензойной кислоты, таких как бензилбензоат, используемый как искусственный ароматизатор и репеллент.
Бензоатные пластификаторы, такие как гликоль-, диэтиленгликоль- и триэтиленгликолевые эфиры, получаемые переэтерефикацией метилбензоата с соответствующим диолом. Альтернативно эти вещества получаются действием бензоилхлорида на соответствующий диол
Эти пластификаторы используются с соответствующими эфирами терефталевой кислоты.
Фенол, C6H5OH, получаемый окислительным декарбоксилированием при 300—400 °C. Необходимая температура, может быть понижена до 200 °C добавлением каталитических количеств солей меди (II). Далее фенол может быть конвертирован в циклогексанол, который служит исходным веществом в синтезе нейлона.
Консервант
Бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213).
Бензойная кислота, блокируя ферменты, замедляет обмен веществ во многих одноклеточных микроорганизмах и грибках. Она подавляет рост плесени, дрожжей и некоторых бактерий.
В пищевые продукты её добавляют в чистом виде или в виде натриевой, калиевой или кальциевой соли.
Губительное действие на микрофлору начинается с абсорбции бензойной кислоты липидной стенкой клетки.
Поскольку через стенку клетки может проникнуть только недиссоциированная кислота, бензойная кислота проявляет антимикробное действие только в кислых пищевых продуктах.
Если внутриклеточный pH 5 или меньше, анаэробная ферментация глюкозы через фосфорфруктокиназу уменьшается на 95 %. Эффективность бензойной кислоты и бензоатов зависит от кислотности (pH) пищи.
Кислая пища, напитки, такие, как фруктовые соки, (содержащие лимонную кислоту), газированные напитки, содержащие в растворе (углекислый газ), безалкогольные напитки с (фосфорной кислотой), соленья (молочная кислота) и другие кислые пищевые продукты консервируются бензойной кислотой и её солями.
Принятые и оптимальные концентрации бензойной кислоты при консервации пищи 0,05—0,1 %.
Медицина
Бензойную кислоту применяют в медицине при кожных заболеваниях, как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, при трихофитиях и микозах, а её натриевую соль, — бензоат натрия — как отхаркивающее средство.
Другие применения
Эфиры бензойной кислоты (со спиртами от метилового до амилового) обладают сильным и приятным запахом и применяются в парфюмерной промышленности.
Производство
Промышленные препараты
Бензойная кислота производятся коммерчески частичным окислением из толуола с кислородом . Процесс катализируется нафтенатами кобальта или марганца . В этом процессе используется большое количество материалов, и он идет с высоким выходом.
Первый промышленный процесс включал реакцию бензотрихлорида (трихлорметилбензола) с гидроксидом кальция в воде с использованием железа или солей железа в качестве катализатора . Полученный бензоат кальция превращается в бензойную кислоту с помощью соляной кислоты . Продукт содержит значительное количество производных хлорированной бензойной кислоты. По этой причине бензойная кислота для потребления человеком была получена сухой перегонкой бензоина камеди. Пищевая бензойная кислота теперь производится синтетическим путем.
Лабораторный синтез
Бензойная кислота дешевая и легкодоступная, поэтому лабораторный синтез бензойной кислоты в основном практикуется из-за ее педагогической ценности. Это обычная подготовка к бакалавриату.
Бензойную кислоту можно очистить перекристаллизацией из воды из-за ее высокой растворимости в горячей воде и плохой растворимости в холодной воде. Избегание использования органических растворителей для перекристаллизации делает этот эксперимент особенно безопасным. Этот процесс обычно дает около 65% выхода.
Путем гидролиза
Подобно другим нитрилам и амидам , бензонитрил и бензамид можно гидролизовать до бензойной кислоты или ее сопряженного основания в кислотных или основных условиях.
Из реактива Гриньяра
Бромбензол можно превратить в бензойную кислоту «карбоксилированием» промежуточного фенилмагнийбромида
Этот синтез предлагает студентам удобное упражнение для проведения реакции Гриньяра , важного класса реакций образования углерод-углеродных связей в органической химии.
Влияние кислот на кожу
Эти вещества обладают множеством полезных свойств. Прежде всего их используют для омоложения и очищения эпителия. При систематическом и правильном применении таких средств уже через 2 недели можно добиться целого ряда результатов:
- вывести из дермы избыток влаги – как следствие, удается уменьшить отечность;
- нормализовать кислотно-щелочной баланс в структуре дермы;
- наладить работу сальных желез;
- сделать кожу более нежной и эластичной;
- разгладить морщины и сделать их менее выраженными;
- справиться с высыпаниями и постакне;
- облегчить протекание кожных патологий и ускорить процесс выздоровления;
- осветлить пигментацию, сделать пятна менее заметными или полностью устранить их;
- очистить и сузить поры;
- уменьшить число черных точек;
- сократить вероятность появления злокачественных эпителиом;
- увлажнить эпителий;
- повысить сопротивляемость кожи внешним факторам – воздействию ультрафиолета, морозов, инфекций;
- укрепить сосуды;
- уменьшить шелушения;
- справиться со шрамами, растяжками, рубцами.
Хотя кислоты имеют обширную сферу применения, не стоит считать такие средства универсальными. Подобные вещества оказывают целенаправленное действие. Их можно применять в качестве омолаживающих средств для устранения морщин или использовать для купирования воспаления. Также вещества способствуют отбеливанию кожи, помогая справляться с пигментацией.

Чтобы добиться ощутимых результатов, нужно определить характер проблемы и подобрать оптимальный состав средства. Каждый из продуктов с содержанием кислот имеет специфические характеристики.
Применение
Зарегистрированные препараты на основе бензойной кислоты разрешены к применению против болезней cвеклы сахарной (кагатные гнили).
В результате проведенных производственных испытаний установлено положительное влияние препарата на сохранность корнеплодов сахарной свеклы в условиях открытых кагатов. Выявлено, что после 20 и 40 суток хранения сырья содержание гнилой массы в среднем составило на контроле 1,85 и 3,0% – 0,9 и 1,6% к массе свеклы.
Применение препарата с рациональной нормой расхода жидкости способствовало снижению загнивания корнеплодов в сравнении с контрольным вариантом в среднем на 48,4%. Экспериментально выявлено, что обработка корнеплодов позволила снизить среднесуточные потери массы свеклы и сахара на 40,9 и 32,7%.
Лабораторный синтез и очистка[править | править код]
Химический продукт — бензойная кислота — дешёв и легкодоступен. Поэтому к лабораторному синтезу профессиональные химики прибегают редко.
Демонстрационный синтез осуществляется в учебных целях.
Очистку бензойной кислоты удобно проводить перекристаллизацией из растворителя, обычно, из воды. Другие растворители, пригодные для перекристаллизации: уксусная кислота (ледяная и водный раствор), бензол, ацетон, петролейный эфир и смесь этанола с водой.
Реакция Канниццароправить | править код
Бензальдегид в основной среде претерпевает преобразование по реакции Канниццаро. В итоге получается бензойная кислота и бензиловый спирт.
Реакция Гриньяраправить | править код
Из бромбензола по реакции карбоксилирования фенилмагнийбромида.
-
- C6H5MgBr+CO2→C6H5COOMgBr{\displaystyle {\mathsf {C_{6}H_{5}MgBr+CO_{2}\rightarrow C_{6}H_{5}COOMgBr}}}
-
- C6H5COOMgBr+HCl→C6H5COOH+MgBrCl{\displaystyle {\mathsf {C_{6}H_{5}COOMgBr+HCl\rightarrow C_{6}H_{5}COOH+MgBrCl}}}
Окислениеправить | править код
Толуол или бензиловый спирт могут быть окислены подкисленным раствором перманганата калия до бензойной кислоты:
-
- 5C6H5CH3+6KMnO4+9H2SO4→5C6H5COOH+3K2SO4+6MnSO4+14H2O{\displaystyle {\mathsf {5C_{6}H_{5}CH_{3}+6KMnO_{4}+9H_{2}SO_{4}\rightarrow 5C_{6}H_{5}COOH+3K_{2}SO_{4}+6MnSO_{4}+14H_{2}O}}}
-
- 5C6H5CH2OH+4KMnO4+6H2SO4→5C6H5COOH+4MnSO4+2K2SO4+11H2O{\displaystyle {\mathsf {5C_{6}H_{5}CH_{2}OH+4KMnO_{4}+6H_{2}SO_{4}\rightarrow 5C_{6}H_{5}COOH+4MnSO_{4}+2K_{2}SO_{4}+11H_{2}O}}}
Ароматические вещества в шампунях
Ароматизаторы в ингредиентах шампуня
Для приятного запаха в шампуни добавляют ароматизаторы как искусственного так и натурального происхождения. В зависимости от сырья, из которого получают ароматизаторы, они могут быть как вполне безвредными, так и достаточно токсичными.
Иногда натуральный ароматизатор может вызвать даже более неприятные последствия, чем синтетический, например приступ аллергии.
Если Вы склонны к аллергии или просто не хотите подвергаться воздействию широкого класса ароматических веществ, выбирайте средства с маркировкой «Fragrance free».
Фталаты в составе шампуня
Для устойчивости аромата в шампуни добавляют фталаты — очень вредные химические вещества — эфиры фталевой кислоты, получаемые путем окисления нафталина, которые накапливаются в организме и вызывают серьезные заболевания.
Химический состав современных шампуней достаточно сложный, он может содержать десятки наименований химических веществ и их соединений. Часть веществ могут оказаться опасными для здоровья. Для снижения опасности аллергических реакций, рекомендуем использовать натуральное мыло.
Применение
По внешнему виду бензойная кислота – продолговатые кристаллы белого цвета, которые имеют характерный блеск. При температуре 122 градуса по Цельсию переходит в газообразное состояние. Бензойная кислота растворима в спиртах, воде, жирах. В промышленных масштабах производится путем окисления толуола. Помимо этого, вещество получают из фталевой кислоты.
Консервант используется в хлебопекарной, кондитерской, пивоваренной промышленностях для производства следующей продукции:
- фруктовых и овощных пюре;
- безалкогольных напитков;
- ягодных соков;
- рыбных продуктов;
- консервированных фруктов, оливок;
- мороженого;
- варенья, джема, повидла;
- овощной консервации;
- маргарина;
- жевательной резинки;
- конфет и сахарозаменителей;
- деликатесной икры;
- молочных изделий
- ликера, пива, вина.
Антисептические, антибактериальные способности бензойной кислоты используют в фармакологической промышленности для производства противогрибковых медикаментов, мазей от чесотки. А специальные ванночки для стоп с применением органического соединения избавляют от чрезмерной потливости, грибка ног. Помимо этого, бензойную кислоту добавляют в сиропы от кашля, поскольку она обладает отхаркивающим свойством и разжижает мокроту.
В качестве консервирующего вещества ее используют в косметике для сохранения полезных свойств и продления срока годности кремов, лосьонов, бальзамов. Благодаря сильным отбеливающим свойствам, соединение входит в состав масок, действие которых направлено на избавление лица от веснушек, неровностей на коже, пигментных пятен.
Лабораторный синтез и очистка
Химический продукт — бензойная кислота — дешёв и легкодоступен. Поэтому к лабораторному синтезу профессиональные химики прибегают редко.
Демонстрационный синтез осуществляется в учебных целях.
Очистку бензойной кислоты удобно проводить перекристаллизацией из растворителя, обычно, из воды. Другие растворители пригодные для перекристаллизации: уксусная кислота (ледяная и водный раствор), бензол, ацетон, петролейный эфир и смесь этанола с водой.
Реакция Канниццаро
Бензальдегид в основной среде претерпевает преобразование по реакции Канниццаро. В итоге получается бензойная кислота и бензиловый спирт.
Реакция Гриньяра
Из бромбензола по реакции карбоксилирования фенилмагнийбромида.
-
- C6H5MgBr + CO2 → C6H5COOMgBr
-
- C6H5COOMgBr + HCl → C6H5COOH + MgBrCl
Окисление
Толуол или бензиловый спирт могут быть окислены подкисленным раствором перманганата калия до бензойной кислоты:
-
- 5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
-
- 5C6H5CH2OH + 4KMnO4 + 6H2SO4 → 5C6H5COOH + 4MnSO4 + 2K2SO4 + 11H2O
Производство
Промышленные препараты
Бензойная кислота коммерчески производится частичное окисление из толуол с кислород. Процесс катализируется кобальт или же марганец нафтенаты. В процессе используется большое количество материалов, и он идет с высоким выходом.
Первый промышленный процесс включал реакцию бензотрихлорид (трихлорметилбензол) с гидроксид кальция в воде, используя утюг или соли железа как катализатор. Результирующий бензоат кальция превращается в бензойную кислоту с соляная кислота. Продукт содержит значительное количество производных хлорированной бензойной кислоты. По этой причине бензойная кислота для потребления человеком была получена сухой перегонкой бензоина камеди. Пищевая бензойная кислота теперь производится синтетическим путем.
Лабораторный синтез
Бензойная кислота дешевая и легкодоступная, поэтому лабораторный синтез бензойной кислоты в основном практикуется из-за ее педагогической ценности. Это обычная подготовка к бакалавриату.
Бензойную кислоту можно очистить перекристаллизация из воды из-за его высокой растворимости в горячей воде и плохой растворимости в холодной воде. Избегание использования органических растворителей для перекристаллизации делает этот эксперимент особенно безопасным. Этот процесс обычно дает около 65% выхода.
Путем гидролиза
Как и другие нитрилы и амиды, бензонитрил и бензамид может быть гидролизован до бензойной кислоты или ее сопряженного основания в кислотных или основных условиях.
Из реактива Гриньяра
Бромбензол может быть превращен в бензойную кислоту путем «карбоксилирования» промежуточного соединения фенилмагний бромид. Этот синтез предлагает студентам удобное упражнение для выполнения Реакция Гриньяра, важный класс углерод-углеродная связь образующая реакция в органической химии.
Бензойная кислота, 2- (ацетилокси) — (CAS 50-78-2)
Собственность Значение Блок Источник
Δ f G ° -371,98 кДж / моль Joback Расчетная недвижимость
Δ f H ° газ -513,64 кДж / моль Joback Расчетная недвижимость
Δ фус H ° 21.19 кДж / моль Joback Расчетная недвижимость
Δ пар H ° 71,151919
кДж / моль Joback Расчетная недвижимость
log P окт / ват 1,31 Криппен Расчетная недвижимость
P c 4082,92 кПа Joback Расчетная недвижимость
T кипятят 659.32 К Joback Расчетная недвижимость
Т с 868,49 К Joback Расчетная недвижимость
Т фус К
Т фус 409,00 ± 3,00 К NIST
Т фус 414,00 ± 4,00 К NIST
Т фус 405.00 ± 12,00 К NIST
Т фус 412,00 ± 5,00 К NIST
Т фус 403,00 ± 8,00 К NIST
Т фус 415,00 ± 3,00 К NIST
Т фус 414,00 ± 5,00 К NIST
Т фус 410.00 ± 6,00 К NIST
Т фус 410,00 ± 5,00 К NIST
Т фус 402,00 ± 10,00 К NIST
Т фус 405,00 ± 10,00 К NIST
Т фус 388,00 ± 15,00 К NIST
Т фус 388.00 ± 15,00 К NIST
Т фус 387,00 ± 15,00 К NIST
Т фус 409,80 ± 4,00 К NIST
Т фус 408,00 ± 5,00 К NIST
Т фус 406,00 ± 5,00 К NIST
Т фус 402.00 ± 6,00 К NIST
Т фус 401,00 ± 6,00 К NIST
Т фус 396,00 ± 8,00 К NIST
Т фус 387,00 ± 8,00 К NIST
Т фус 397,00 ± 8,00 К NIST
Т фус 388.00 ± 8,00 К NIST
Т фус 396,00 ± 6,00 К NIST
Т фус 394,00 ± 6,00 К NIST
Т фус 392,00 ± 6,00 К NIST
Т фус 373,00 ± 6,00 К NIST
Т фус 391.00 ± 6,00 К NIST
Т фус 373,00 ± 6,00 К NIST
Т фус 381,00 ± 10,00 К NIST
Т фус 383,00 ± 10,00 К NIST
Т фус 416,00 ± 3,00 К NIST
Т фус 400.00 ± 2,00 К NIST
Т фус 395,00 ± 2,00 К NIST
Т фус 391,00 ± 2,00 К NIST
Т фус 408,00 ± 5,00 К NIST
Т фус 416,00 ± 3,00 К NIST
Т фус 406.00 ± 10,00 К NIST
Т фус 404,90 ± 2,00 К NIST
Т фус 404,50 ± 2,00 К NIST
Т фус 407,10 ± 2,50 К NIST
Т фус 406,40 ± 2,00 К NIST
Т фус 407.80 ± 2,00 К NIST
Т фус 407,00 ± 2,50 К NIST
Т фус 404,50 ± 2,00 К NIST
Т фус 404,30 ± 2,00 К NIST
Т фус 405,80 ± 2,00 К NIST
Т фус 405.30 ± 2,00 К NIST
Т фус 409,00 ± 2,50 К NIST
Т фус 407,30 ± 2,00 К NIST
Т фус 405,25 ± 2,00 К NIST
Т фус 403,50 ± 2,00 К NIST
Т фус 406.80 ± 2,00 К NIST
Т фус 405,90 ± 2,00 К NIST
Т фус 409,30 ± 2,00 К NIST
Т фус 407,10 ± 2,00 К NIST
Т фус 404,70 ± 2,00 К NIST
Т фус 404.80 ± 2,00 К NIST
Т фус 406,50 ± 2,00 К NIST
Т фус 407,90 ± 2,00 К NIST
Т фус 407,50 ± 2,50 К NIST
Т фус 407,50 ± 2,00 К NIST
Т фус 404.10 ± 2,00 К NIST
Т фус 404,30 ± 2,00 К NIST
Т фус 407,20 ± 2,50 К NIST
Т фус 406,70 ± 2,00 К NIST
Т фус 406,30 ± 2,00 К NIST
Т фус 407.60 ± 2,00 К NIST
Т фус 407,20 ± 2,00 К NIST
Т фус 402,20 ± 4,00 К NIST
Т фус 406,70 ± 2,00 К NIST
Т фус 406,20 ± 2,00 К NIST
Т фус 407.20 ± 2,00 К NIST
Т фус 407,20 ± 2,00 К NIST
Т фус 407,70 ± 2,00 К NIST
Т фус 408,00 ± 2,00 К NIST
Т фус 406,20 ± 2,00 К NIST
Т фус 409.00 ± 2,00 К NIST
Т фус 408,20 ± 2,00 К NIST
Т фус 406,80 ± 0,50 К NIST
Т фус 406,80 ± 0,50 К NIST
Т фус 406,60 ± 0,50 К NIST
Т фус 407.80 ± 2,00 К NIST
Т фус 402,10 ± 4,00 К NIST
Т фус 402,50 ± 4,00 К NIST
Т фус 405,90 ± 3,00 К NIST
Т фус 406,90 ± 3,00 К NIST
Т фус 407.00 ± 3,00 К NIST
Т фус 408,00 ± 1,50 К NIST
Т фус 407,40 ± 0,50 К NIST
Т фус 407,70 ± 0,50 К NIST
Т фус Выброс 134.80 ± 0.50 К NIST
Т фус 407.00 ± 3,00 К NIST
Т фус 412,00 ± 4,00 К NIST
Т фус 407,20 ± 2,00 К NIST
Т фус 407,20 ± 2,00 К NIST
Т фус 407,10 ± 3,00 К NIST
Т фус 407.50 ± 2,00 К NIST
Т фус 405,40 ± 1,00 К NIST
Т фус 407,90 ± 2,00 К NIST
Т фус 405,40 ± 1,00 К NIST
Т фус 407,90 ± 2,00 К NIST
Т фус 405.40 ± 1,00 К NIST
Т фус 407,90 ± 2,00 К NIST
Т фус 405,20 ± 2,00 К NIST
Т фус Выброс 273,15 ± 5,00 К NIST
Т фус 405,00 ± 3,00 К NIST
Т фус 398.00 ± 6,00 К NIST
Т фус 397,70 ± 3,00 К NIST
Т фус Выброс 510,00 ± 4,00 К NIST
Заключение
Однозначно ответить на вопрос, что приносит применение benzoic acid в косметике – вред или пользу — нельзя. Следует пристально рассмотреть каждую ситуацию. И, если есть возможность побаловать себя брусникой, клюквой или натуральной косметикой на их основе, не упускать такую возможность.
Кислоты довольно часто используются для ухода за кожей лица. Они входят в косметические продукты и применяются для проведения различных процедур. С помощью подобных средств удается справиться с воспалениями, устранить пигментные пятна, добиться омолаживающего эффекта и сделать овал лица более четким.






