Notes
- Carbon dioxide: IDLH Documentation16 August 2006. National Institute for Occupational Safety and Health. July 20, 2007.
- M. Santoro et al. 2006. «Amorphous silica-like carbon dioxide.» Nature 441 (7095): 857-860 issn 0028-0836
- Joseph Priestley. Observations on Different Kinds of Air. Philosophical Transactions 62 (1772): 147-264 issn = 0260-7085 Retrieved July 20, 2007.
- Humphry Davy. On the Application of Liquids Formed by the Condensation of Gases as Mechanical Agents. Philosophical Transactions 113 (1823): 199-205 issn = 0261-0523 Retrieved July 20, 2007.
- Duane H.D. Roller and M. Thilorier. Thilorier and the First Solidification of a «Permanent» Gas (1835). Isis 43 (2)(1952): 109-113 issn = 0021-1753 Retrieved July 20, 2007.
- ↑ Ronald Pierantozzi. Carbon Dioxide. Kirk-Othmer Encyclopedia of Chemical Technology. (Wiley, 2001) 10.1002/0471238961.0301180216090518.a01.pub2 Retrieved July 20, 2007.
- G.W. Petty. A First Course in Atmospheric Radiation. (Madison, WI: Sundog Publishing, 004. ISBN 0972903313), 229-251
- Historical CO2 record derived from a spline fit (20 year cutoff) of the Law Dome DE08 and DE08-2 ice cores. accessdate July 20, 2007.
- Trends in Atmospheric Carbon Dioxide — Mauna Loa Earth Systems Research Laboratory.accessdate July 20, 2007.
- T.J. Blom, W.A. Straver, F.J. Ingratta, Shalin Khosla, and Wayne Brown. Carbon Dioxide In Greenhouses , 2002-12 accessdate July 20, 2007.
- Falkowski, P. and Scholes, R.J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; Hogberg, P.; Linder, S.; Mackenzie, F.T.; Moore, B 3rd.; Pedersen, T.; Rosenthal, Y.; Seitzinger, S.; Smetacek V.; Steffen W. (2000). The global carbon cycle: a test of our knowledge of earth as a system. Science 290 (5490): 291-296.
- ↑ Solar Navigator on Carbon Dioxide. Retrieved July 20, 2007.
- Jerry Hannan Your Role in the «Greenhouse Effect» accessdate July 20, 2007.
Как работает тест
Врач или медсестра возьмут образец вашей крови из вашей руки с помощью иглы. Сообщите своему врачу, если вы принимаете какие-либо лекарства или добавки, потому что они могут повлиять на результаты. Так же можно есть грейпфруты, мандарины и другие фрукты с высоким содержанием кислоты.
Тест использует только жидкость в вашей крови, а не клетки крови или тромбоциты, которые помогают вашему сгустку крови. Лаборант добавит кислоту в жидкость, чтобы разблокировать углекислый газ из бикарбоната. Количество бикарбоната измеряется тем, насколько быстро изменяется кислотность образца.
Credits
New World Encyclopedia writers and editors rewrote and completed the Wikipedia article
in accordance with New World Encyclopedia standards. This article abides by terms of the Creative Commons CC-by-sa 3.0 License (CC-by-sa), which may be used and disseminated with proper attribution. Credit is due under the terms of this license that can reference both the New World Encyclopedia contributors and the selfless volunteer contributors of the Wikimedia Foundation. To cite this article click here for a list of acceptable citing formats.The history of earlier contributions by wikipedians is accessible to researchers here:
Carbon dioxide history
The history of this article since it was imported to New World Encyclopedia:
History of «Carbon dioxide»
Note: Some restrictions may apply to use of individual images which are separately licensed.
Немного об использовании дрожжей
, 2000
Несмотря на простоту, доступность и дешевизну использования
СО2, полученного в результате спиртового брожения, у этого способа
масса недостатков. Так что рекомендую сразу присмотреться к цивилизованному
способу получения СО2, т.е. из специальных баллонов.
Получение СО2 из бутылки с бродящими дрожжами
неплохо попробовать для начала, чтобы убедиться в наличие положительного эффекта
от его применения. В этом вы наверняка убедитесь достаточно скоро, если нет,
то и баллон вам не понадобится, и деньги сохраните.
Теперь о том, где и какие купить дрожжи. Первый и наиболее
простой способ узнать, где же их купить, это спросить у жены, сестры, матери
или, в конце концов, у продавца, практически любого продовольственного магазина.
Если это не помогло, то идите в продовольственный магазин, ищите отдел, который
давным-давно назывался «Бакалея», сейчас это там где торгуют сахаром, мукой,
макаронами и т.д. Называется товар, который вам нужен — «сухие, активные (быстрые
и т.п.) дрожжи», в основном импортные, отечественных аналогов я не встречал.
Расфасованы дрожжи в пакетики, похожие, например, на суп быстрого приготовления
или сухой сок. Есть большие и маленькие пакетики, масса первых 100г, вторых
15г. Соответственно, цена на начало 2000 года составляла 12-15 руб. (0.5$)
за большой пакетик и 3-4 руб.(0.1$) за маленький. Брать выгоднее конечно большой,
уходят быстро, а срок хранения у сухих дрожжей достаточный. У нас на рынке
представлены дрожжи турецкие (Pasha, Pakmaya, Conmaya и другие) и французские
(Саф-Момент). Стоимость и расфасовка — одинаковые. По моему опыту французские
лучше. Бродят дольше, лучше растворяются в воде, хотя серьезных исследований
по сравнению дрожжей я не проводил, а утверждения совершенно субъективны и
основаны только на наблюдениях. Так что вы вполне можете провести эксперименты
и доказать обратное. Да есть еще и отечественные дрожжи, но они не сухие,
а вроде как «живые», и продаются в виде брикетов, похожих на хозяйственное
мыло, в основном на рынках. По этому типу дрожжей у меня опыта никакого нет,
но думаю, что они явно уступают импортным, хотя может и нет, попробуйте!
Хочется так же сказать о недостатках, выявленных в период
использования «дрожжевого» способа получения СО2. Они не новы,
просто еще одно подтверждение.
Нестабильность процесса, т.е. первые два-три дня процесс
идет достаточно интенсивно, потом затихает. Этот недостаток меня просто достает,
приходишь с работы, а СО2 уже и нет. Естественно для аквариумной
среды это не полезно.
Невозможность регулировки. С этим понятно, одно дело
мне с артезианской, жесткой водой, можно дуть СО2 чем, больше,
тем лучше, и другое дело если вода мягкая, можно рыб и заморить. Несоблюдение
пропорций в рецептуре приготовления закваски ведет к достаточно неприятным
последствиям. Процесс брожения может пойти через край, и естественно продукты
брожения попадают в банку. Если на конце трубки стоит керамический распылитель,
то с ним в этом случае придется, скорее всего, расстаться. Он забивается и
прочистке не поддается. Аквариум от мути очищается, в принципе, достаточно
быстро, тяжелых последствий, на первый взгляд, не наблюдается.
Заряжать каждую неделю-две новую порцию, тоже занятие
не сахар. Кстати и сахар, и дрожжи тоже денег стоят. Так что желающие могут
посчитать срок окупаемости баллона с СО2, я думаю что стоит все
же вложить деньги в баллон.
Когда я смогу пройти тест?
Обычно это часть более крупного теста на электролит, который говорит вашему врачу, сколько натрия, калия и хлорида в вашем организме. Они могут пройти этот тест в рамках регулярного обследования или попытаться выяснить, почему вы не чувствуете себя хорошо.
Ваш врач может проверить уровень CO2 в вашей крови, если у вас есть:
- Рвота или диарея, которые не исчезнут
- Затрудненное дыхание
- Слабость или усталость
Если вас лечат от заболеваний печени, легких или пищеварительной системы, ваш врач может регулярно проверять уровень бикарбоната, чтобы проверить, работает ли ваша терапия или лекарства.
Не переборщи!
Безусловно, СО2, подаваемый в растительный аквариум в разумных количествах, стимулирует рост и развитие растений
Но ключевое слово здесь – «в разумных»! Прежде, чем переходить к описанию систем подачи углекислоты, хочется напомнить, что по неосторожности можно, как известно, сломать и такие части тела, которые к переломам не слишком предрасположены 😉 . И если избыточной аэрацией, к примеру, навредить аквариуму сложно, то избыток СО2 запросто способен потравить ваших рыб и креветок, поэтому контроль за его концентрацией необходим. И первое, что необходимо приобрести прежде, чем вы начнёте кормить свои растения углекислым газом – это индикатор его содержания
Оптимальная концентрация СО2 в аквариуме – 5-20 мг/л. Содержание углекислоты менее 3 мг/л грозит растениям голодом, а 30 мг/л – концентрация, опасная для рыб и беспозвоночных.
Карбонатная жёсткость, кислотность воды и концентрация СО2 — это взаимозависимые параметры, поэтому зная два из них можно определить третий. Более точно понять, какова концентрация СО2 в вашем аквариуме, вам помогут индикаторы карбонатной жесткости (kH) и кислотности (pH) воды, а также вот такая таблица:

С помощью счётчика пузырьков необходимо отрегулировать подачу углекислого газа из вашей системы в аквариум так, чтобы его содержание находилось в «зелёной» области. Если ваш аквариум стабилен, то обычно бывает достаточно раз в месяц-два отрегулировать по индикатору, запомнить скорость подачи газа в пузырьках в минуту, и в дальнейшем просто поддерживать подачу с этой постоянной скоростью. На ночь подачу СО2 нужно отключать (вручную или автоматическим клапаном), иначе ночью pH воды будет сильно понижаться.
Можно упростить процедуру, приобретя стеклянный индикатор содержания СО2 в воде, так называемый «дроп-чекер». Цвет жидкости в нём изменяется в зависимости от концентрации углекислого газа, и означает то же самое, что и цвета в табличке на рисунке: жёлтый – много СО2, голубой – мало, а зелёный – в самый раз. До жёлтой окраски лучше не доводить никогда: обычно жидкость в дроп-чекере желтеет уже тогда, когда концентрация превысила опасный для рыб уровень. Учтите ещё, что «дроп-чекер» — прибор довольно «тормозной», и реагирует на изменения не сразу, поэтому после изменения скорости подачи газа надо подождать полчасика, прежде чем его показания начнут соответствовать реальности. Индикаторная жидкость в дроп-чекерах работает до трёх месяцев, потом она бледнеет, мутнеет, и требует замены. Кстати, продающиеся в зоомагазинах жидкости для дроп-чекеров разных брендов вполне взаимозаменяемы (их состав совершенно одинаков).
Многие литературные источники советуют при обычной в наших аквариумах карбонатной жесткости около kH=4 устанавливать скорость подачи углекислого газа порядка 5 пузырьков в минуту на каждые 50 литров объёма аквариума. Понятно, что эта цифра приблизительна, но регулировать подачу по индикаторам лучше, начав именно с неё. иначе опять-таки есть риск «переборщить».
Interesting Facts
- Carbon dioxide is the fourth most abundant gas in the atmosphere (after nitrogen, oxygen, and argon) with a concentration of about 0.036 percent. Researchers have found that the concentration of carbon dioxide in the atmosphere has been increasing at a regular rate for at least the last forty years. They believe that the reason for this increase is the escalating use of fossil fuels by humans to heat homes and offices; drive cars, trucks, trains, and airplanes; and to power industrial operations. They further suspect that an increase in the amount of carbon dioxide in the atmosphere may have significant long-term effects on the planet’s climate.
- Scientists have become very interested in a form of carbon dioxide known as supercritical carbon dioxide (SCCO2 or SC-CO2). Under the proper conditions of temperature and pressure, carbon dioxide (as SCCO2) behaves as both a liquid and a gas at the same time. This property has proved to be very valuable in using SCCO2 as a highly efficient solvent that has no environmental disadvantages.
In addition to its role in natural processes, carbon dioxide has many commercial and industrial applications. One of the most important uses is in the carbonation of beverages. Although beers and sparkling wines contain carbon dioxide from natural sources (the fermentation of sugars by yeasts), nearly all carbonated beverages have their carbon dioxide added artificially. The carbon dioxide adds a zesty taste to the beverage and helps to preserve it.
Carbon dioxide is also used as a fire extinguishing agent. Its use for this purpose is based on the facts that it does not burn itself and is heavier than air. Thus, when sprayed on a fire, carbon dioxide settles down on top of the flames and prevents oxygen from reaching the burning material. The carbon dioxide can be supplied in a variety of ways in a fire extinguisher. In some devices, carbon dioxide gas is produced as the result of a chemical reaction that occurs within the fire extinguisher. In other devices, liquid carbon dioxide is released from the extinguisher.
Carbon dioxide is also used in gaseous, liquid, or solid form as a refrigerant. As a gas, it is used as the «working fluid» in refrigerators, the fluid that circulates through the refrigerator changing back and forth from gas to liquid, absorbing heat in the process. In the form of dry ice, carbon dioxide is a very efficient and convenient method for cooling objects to very low temperatures (close to the sublimation point of carbon dioxide, about −78.4°C (−109°F).
2021
Россия вошла в тройку стран по выбросам углекислого газа
В начале октября 2021 года организация Carbon Brief опубликовала результаты анализа общего объема выбросов углекислого газа странами с 1850 года. Исследование показало государства, несущие наибольшую историческую ответственность за чрезвычайную ситуацию с климатом.
США признана крупнейшим загрязнителем на планете Земля, за ней следует Китай и Россия. Далее более ровно по общим объемам расположились страны: Бразилия, Индонезия, Германия, Индия, Великобритания, Япония и Канада. Углекислый газ остается в атмосфере в течение столетий, а совокупный объем выбросов CO2 тесно связан с потеплением на +2°C, которое уже произошло в мире.
Данные также показывают, что мир к октябрю 2021 года использовал 85% бюджета CO2, который дает 50% шанс ограничить потепление до +1,5°C, опасного предела, согласованного в Париже в 2015 году. США, Германия, Великобритания и Канада, единственные из 10 ведущих стран, которые взяли на себя обязательства по более глубокому сокращению выбросов в преддверии конференции ООН по изменению климата (COP26). Хотя США заявили, что удвоят свой вклад в финансирование борьбы с изменением климата для развивающихся стран, некоторые считают, что это слишком мало со стороны крупнейшей экономики мира.
 Россия вошла в тройку стран по выбросам углекислого газа, среди лидеров также США и Китай
Россия вошла в тройку стран по выбросам углекислого газа, среди лидеров также США и Китай
Россия взяла на себя новое обязательство, но оно допускает рост выбросов, а группа по отслеживанию климатических действий (CAT) оценивает его, как критически недостаточное по сравнению с парижскими целями. Китай и Индия еще не сделали никаких новых обещаний, а Бразилия, Индонезия и Япония не улучшили предыдущие обещания.
Анализ Carbon Brief показывает, что около 85% совокупных выбросов США и Китая связаны со сжиганием ископаемого топлива, а 15% с вырубкой лесов, в то время как в Бразилии и Индонезии наблюдается обратная картина. Индонезия добилась определенного прогресса в прекращении вырубки деревьев, но вырубка лесов в Бразилии ускорилась при нынешнем президенте Жаире Болсонару.
США были крупнейшим совокупным загрязнителем с 1850 года и по 7 октября 2021, такой и остается. Россия была вторым крупнейшим загрязнителем до 2007 года, когда ее выбросы превзошел Китай, чьи выбросы начали быстро расти с 1970 года. Великобритания была третьим крупнейшим загрязнителем в течение с 1870 года до 1970 года, а после ее обогнала Бразилия.
В анализе Carbon Brief использовались данные информационно-аналитического центра по двуокиси углерода, Global Carbon Project, Carbon Monitor и исследования по выбросам от обезлесения и изменений в землепользовании. Анализ начинается с 1850 года, до которого достоверных данных мало, поэтому он не включает выбросы от обезлесения, произошедшего до 1850 года. Анализ учитывает изменение государственных границ с течением времени, но не приписывает выбросы из ранее колонизированных стран колонизирующей стране.
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Carbon dioxide emissions by humans
| Due to human activities, the amount of CO2 released into the atmosphere has been rising extensively during the last 150 years. As a result, it has exceeded the amount sequestered in biomass, the oceans, and other sinks. There has been a climb in carbon dioxide concentrations in the atmosphere of about 280 ppm in 1850 to 364 ppm in 1998, mainly due to human activities during and after the industrial revolution, which began in 1850. Humans have been increasing the amount of carbon dioxide in air by burning of fossil fuels, by producing cement and by carrying out land clearing and forest combustion. About 22% of the current atmospheric CO2 concentrations exist due to these human activities, considered that there is no change in natural amounts of carbon dioxide. We will take a closer look at these effects in the next paragraph. |
References
- Butler, James Newton. 1991. Carbon Dioxide Equilibria and Their Applications. Chelsea, Mich: Lewis Publishers. ISBN 0873716248.
- Chang, Raymond. 2006. Chemistry, 9th ed. New York: McGraw-Hill Science/Engineering/Math. ISBN 0073221031
- Cotton, F. Albert, Geoffrey Wilkinson, Carlos A. Murillo, and Manfred Bochmann. 1999. Advanced Inorganic Chemistry, 6th edition. New York: Wiley. ISBN 0471199575
- DeSimone, Joseph M., and William Tumas, eds. 2003. Green Chemistry Using Liquid and Supercritical Carbon Dioxide. Green chemistry. New York: Oxford University Press. ISBN 0195154835.
- Lide, David R. 2006. CRC Handbook of Chemistry and Physics, 87th ed. Boca Raton, FL: CRC Press. ISBN 0849304873
- Mukhopadhyay, Mamata. 2000. Natural Extracts Using Supercritical Carbon Dioxide. Boca Raton, FL: CRC Press. ISBN 0849308194.
- Trabalka, John R. 1985. Atmospheric Carbon Dioxide and the Global Carbon Cycle. Washington, DC: U.S. Dept. of Energy, Office of Energy Research, Office of Basic Energy Sciences, Carbon Dioxide Research Division. ISBN 1410223744.
The part carbon dioxide plays in environmental processes
Carbon dioxide is one of the most abundant gasses in the atmosphere. Carbon dioxide plays an important part in vital plant and animal process, such as photosynthesis and respiration. These processes will be briefly explained here. Green plants convert carbon dioxide and water into food compounds, such as glucose, and oxygen. This process is called photosynthesis. The reaction of photosynthesis is as follows: 6 CO2 + 6 H2O —> C6H12O6 + 6 O2 Plants and animals, in turn, convert the food compounds by combining it with oxygen to release energy for growth and other life activities. This is the respiration process, the reverse of photosynthesis. The respiration reaction is as follows: C6H12O6 + 6 O2 —> 6 CO2 + 6 H2O Photosynthesis and respiration play an important role in the carbon cycle and are at equilibrium with one another. Photosynthesis dominates during the warmer part of the year and respiration dominates during the colder part of the year. However, both processes occur the entire year. Overall, then, carbon dioxide in the atmosphere decreases during the growing season and increases during the rest of the year. Because the seasons in the northern and southern hemispheres are opposite, carbon dioxide in the atmosphere is increasing in the north while decreasing in the south, and vice versa. The cycle is more clearly present in the northern hemisphere; because it has relatively more land mass and terrestrial vegetation. Oceans dominate the southern hemisphere.
Influence of carbon dioxide on alkalinity
Carbon dioxide can change the pH of water. This is how it works: Carbon dioxide dissolves slightly in water to form a weak acid called carbonic acid, H2CO3, according to the following reaction: CO2 + H2O —> H2CO3 After that, carbonic acid reacts slightly and reversibly in water to form a hydronium cation, H3O+, and the bicarbonate ion, HCO3-, according to the following reaction: H2CO3 + H2O —> HCO3— + H3O+ This chemical behaviour explains why water, which normally has a neutral pH of 7 has an acidic pH of approximately 5.5 when it has been exposed to air.
How to reduce greenhouse gas emissions
Virtually every sector of the global economy, from manufacturing to agriculture to transportation to power production, contributes greenhouse gases to the atmosphere, so all of them must evolve away from fossil fuels if we are to avoid the worst effects of climate change. Countries around the world acknowledged this reality with the Paris Climate Agreement of 2015. The changes will be most important among the biggest emitters: Twenty countries are responsible for at least three-quarters of the world’s greenhouse gas emissions, with China, the United States, and India .
The technologies for ramping down greenhouse gas emissions already exist, for the most part. They include swapping fossil fuels for renewable sources, boosting energy efficiency, and discouraging carbon emissions by putting a price on them. (Read more about such solutions here.)
The world technically has only one-fifth of its «carbon budget»—the total is 2.8 trillion metric tons—remaining in order to avoid warming the Earth more than 1.5 degrees Celsius. Halting the trends in motion will require more than just phasing out fossil fuels. In fact, the paths to halting global temperature increases of 1.5 or 2 degrees C, the two goals outlined by the IPCC, rely in some way on adopting methods of sucking CO2 from the sky. Those include planting trees, conserving existing forests and grasslands, and capturing CO2 from power plants and factories.
Сферы использования
Углекислый газ имеет много различных способов применения. Наиболее известными являются следующие:
В медицинских целях для сохранения тканей может потребоваться заморозка. Для этой цели может использоваться сжиженная углекислота. Если её выпустить в условиях комнатной температуры и давления, то она принимает вид белых хлопьев забирая много тепла.
В парфюмерной промышленности сжиженный углекислый газ помогает получать духи с насыщенным запахом. Такая технология позволяет избежать неприятного специфического запаха, который может появляться в некоторых случаях при таких процедурах.
Углекислота позволяет создавать освежающие газированные напитки
Она также используется в качестве важного компонента при составлении некоторых коктейлей.
Когда производится ремонт или осуществляются строительные работы, часто требуется выполнение сварочных работ. Углекислота позволяет выполнять их без образования дополнительного нагара, что существенно улучшает результат работы.
Углекислотные огнетушители отличаются высокой эффективностью при тушении пожара
Их важным достоинством является возможность применять при тушении электрооборудования, так как в этом случае исключён риск возникновения короткого замыкания. Если производится тушение предметов, которые при тушении водой могут испортиться, то в этом случае углекислотные огнетушители будут хорошим выбором.
Использование сухих углекислых ванн является эффективной медицинской процедурой. Газ способствует расширению пор и регенерации клеток кожи. Процедура практически не имеет противопоказаний. Она может применяться даже после инфаркта, так как не создаёт чрезмерной нагрузки на организм.
Баллоны принято делить на категории в соответствии с их объёмом. Те, которые имеют не больше 20 л, считаются малыми, от 20 до 40 — средними, а превышающие 40 л считаются большими.
Производство углекислотыИсточник labirint-vrn.ru
Взаимодействие с землей
Углекислый газ воздуха на генетическом уровне взаимосвязан с землей. Постоянно протекающие почвенные движения увеличивают резервы СО2 в воздухе, где он используется растениями на образование органических элементов. Углекислота выполняет важную функцию в формировании и проветривании почвы. Он принимает участие в разрушении основных минералов, увеличении растворяемости, перемещении карбонатов и фосфатов.
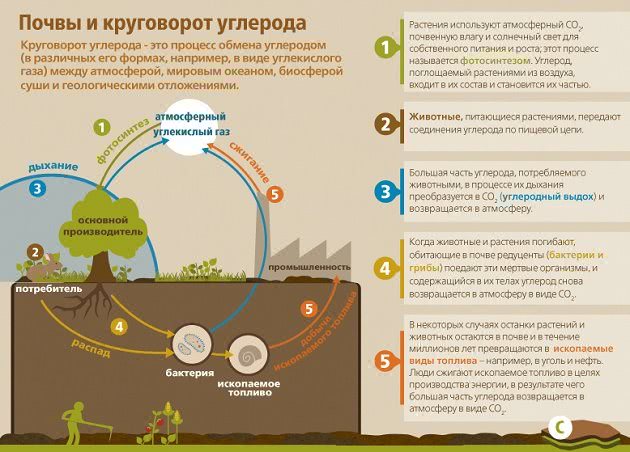
Значительная доля диоксида углерода грунтового воздуха появляется в результате деятельности почвенных организмов, во время распада и окисления органического элемента. До 1/3 части СО2 вырабатывается корнями высоких растений. Также происходит поступление углекислого газа с газами ювенильного и вадозного происхождения из глубочайших шаров земли. В почвах, сформированных на известковых породах, СО2 способен выступать продуктом разрушения углекислого кальция почвенными кислотами.
В почвах с большим содержанием органического вещества концентрация СО2 летом и весной увеличивается до 3-9 %. Черноземные грунты вырабатывают от 2 до 6 кг углекислого газа на протяжении 24 часов. В почвенном воздухе на глубине 75-150 см в два раза больше содержание СО2 нежели в верхних слоях. В теплые времена содержание СО2 в почвенном воздухе в два раз больше чем в зимний период. Объяснить это можно увеличением активности организмов в грунте. Необходимо понимать, что многочисленные способы земледелия приводят к повышению концентрации углекислоты в грунте. Среди них можно выделить:
- органические удобрения;
- травосеяние;
- сжатие катками.
Безусловно, не стоит говорить, что плодородность и качество земли зависит исключительно от углекислоты, есть и другие факторы, влияющие на это. Чтобы регулировать динамику СО2 в почве и увеличивать его содержание до требуемого количества для извлечения хорошего урожая необходимо:
- активировать жизненные процессы в грунте при помощи аэрации;
- осуществлять правильное травосеяние для того чтобы поддерживался и обновлялся резерв органического вещества;
- делать сидерацию и вносить органические удобрения.
Проверка баллона
После истечения пятилетнего срока баллоны для углекислого газа должны проходить проверку. Без её прохождения дальнейшее использование ёмкости невозможно. Освидетельствование может проводить только уполномоченная организация.
Процедура предусматривает проверку состояния оборудования
При этом обращают внимание на следующее:
- Выполняется тщательный осмотр внешнего вида. Не должно присутствовать повреждений или обширных и глубоких следов ржавчины.
- Производится полное удаление углекислого газа из обследуемой ёмкости. Это делают с использованием инертных газов.
- Проверяется исправность работы вентиля.
- Выполняется оценка толщины стенок баллона. Для этого производится его взвешивание. Результат покажет, насколько уменьшился его вес и, соответственно, истончились стенки.
- Гидравлические испытания показывают исправность работы оборудования.
- После проверки выполняется просушка. Это делают с помощью прогретого воздуха.
- При необходимости может производиться замена вентиля или выполняться покраска резервуара.
После того, как проверка окончена, с помощью специального клейма ставят дату проведения и обводят овальной линией. На баллоне должен присутствовать его технический паспорт. В нём содержится такая информация: заводской номер, вместимость в литрах воды, масса при изготовлении, рабочее и проверочное давление в атмосферах, клеймо завода, проводившего переаттестацию.
Вместимость в литрах воды увеличилась, это говорит о возможности образования внутренних трещин или изменении геометрии ёмкости. Если возрастание превысило 1,5%, то это считается признаком неисправности оборудования.
Баллон с углекислым газомИсточник chipmaker.ru
In the Earth’s atmosphere
Carbon dioxide is present at a very small 383 ppm (0.000383) of the volume of the earth’s atmosphere, but it is a very powerful greenhouse gas and so has a large effect upon climate. It is also essential to photosynthesis in plants and other photoautotrophs.
Despite the low concentration, CO2 is a very important component of the Earth’s atmosphere because it absorbs infrared radiation at wavelengths of 4.26 µm (asymmetric stretching vibrational mode) and 14.99 µm (bending vibrational mode) and enhances the greenhouse effect to a great degree.
Although water vapour accounts a substantial fraction of the greenhouse effect, there is no real way to control the amount of water vapor in the Earth’s climate system and it is short-lived in the atmosphere. In addition, water vapor is almost never considered a forcing, but rather almost always a feedback.
On the other hand, carbon dioxide is a very powerful forcing, and it also lasts far longer in the Earth’s atmosphere. With a radiative forcing of about 1.5 W/m2, it is relatively twice as powerful as the next major forcing greenhouse gas, methane, and relatively ten times as powerful as the third, nitrous oxide. Carbon dioxide alone contributes up to 12 percent to the greenhouse effect.
The 20-year smoothed Law Dome DE02 and DE02-2 ice cores show the levels of CO2 to have been 284 ppm in 1832. As of January 2007, the measured atmospheric CO2 concentration at the Mauna Loa observatory was about 383 ppm. Of this 99 ppm rise in 175 years, 70 ppm of it has been in the last 47 years.
Various methods of limiting or removing the amount of carbon dioxide in the atmosphere have been suggested. Current debate on the subject mostly involves economic or political matters at a policy level.






