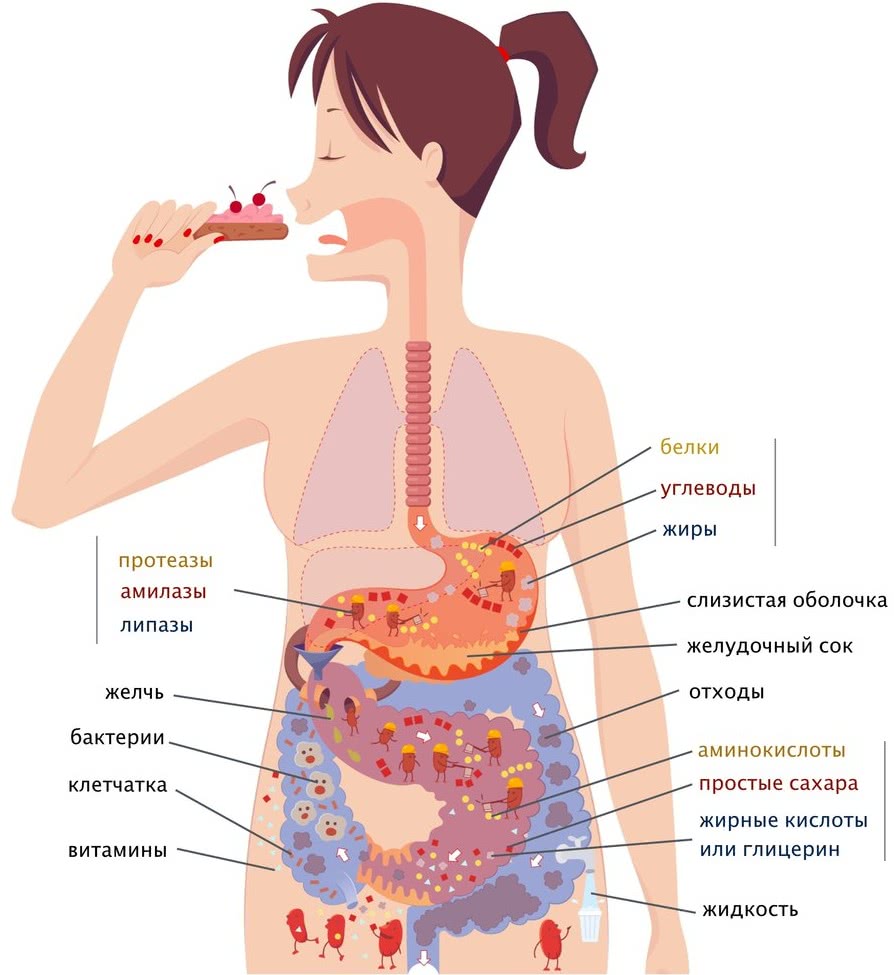
Токсикология
| Шаблон:NFPA 704 |
Фтор представляет собой чрезвычайно агрессивное химическое вещество. Ядовит, является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Резорбтивное действие объясняется возможностью фтора вступать в свободнорадикальные реакции с тканями организма. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век.
Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных полимеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия путём электролиза;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами.
Ракетная техника
Шаблон:Основная статья
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих видов ракетного топлива. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине
Шаблон:Основная статья
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество лекарств, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. применяются для профилактики кариеса (см. ниже).
Дефицит и передозировка фтора
Общепринятая суточная доза F для взрослого человека составляет 1,5-2 мг (немного больше при остеопорозе). Недостаточное потребление этого микроэлемента вызывает кариес, ухудшает зрение, усиливает уязвимость организма перед инфекциями. Последствия хронического F-дефицита:
- разрушение зубов;
- искривление позвоночника;
- ухудшение зрения.
- Функции фтора в организме
- Дефицит и передозировка фтора
- Пищевые источники
- Топ-10 продуктов, необходимых для детей
- Другие гастрономические рекомендации
- Токсичные источники
Передозировка фтором хоть и редко, но все-таки встречается
В случае отравления минералом важно пить много воды (больше 2 литров в сутки) и принимать кальция глюконат (способствует более быстрому выведению фтора из организма). Быстрый эффект для очищения от излишков микроэлемента дают слабительные препараты, содержащие натрия сульфат
Избавиться от проявлений флюороза поможет отбеливание эмали зубов.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
История
Схема атома фтора Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь семьдесят шест лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluorum» (которое происходит, в свою очередь, от fluere
— «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Польза или вред от фторирования воды?
Фторирование водопроводной воды общего пользования противоречиво, и вызывает возражения, имеющие под собой ряд этических и юридических оснований. Впрочем, как использование зубной пасты с фтором.
С одной стороны, для зубов полезно присутствие фтора, но с другой — его избыточное количество принесет в целом вред организму.
Учреждения здравоохранения и стоматологии по всему миру подтверждают безопасность и эффективность фторирования питьевой воды. Но, существуют мнения о его неэффективности и даже опасности. Обоснованных доказательств тому, что фторированная вода укрепляет зубы и кости, на данный момент не предоставлено.
Также известно и то, что если длительное время употреблять фтор, это может привести к печальным последствиям — к возникновению остеопороза, остеомиелиту, болезни и изменению зубов (флюороз), заболеваниям мозга
Некоторые ученые осторожно высказывают мнение, что возможна связь между ростом частоты возникновения болезни Альцгеймера и фторированием воды. Фтор не выводится быстро из организма, но накапливается в костях и зубах
Недавно также было обнаружено, что он накапливается еще более интенсивно в шишковидной железе, находящейся в середине мозга.
Результаты поиска:
| Химическая реакция | Условия |
| Si + 4HF(г) = SiF4 + 2H2 | 40-100° C |
| Si + 2F2 = SiF4 | комн., сгорание во фторе |
| SiO2 + 4HF(г) = SiF4 + 2H2O | 250-400° C |
| SiO2 + 2F2 = SiF4 + O2 | 250-400° C |
| SiO2 + 4NH4(HF2) = SiF4 + 4NH4F + 2H2O | 200-250° C |
| H2[SiF6] = SiF4 + 2HF | комн., в жидк. HF |
| Na2[SiF6] = 2NaF + SiF4 | 570-600° C |
| Na2[SiF6] + H2SO4 (конц.) = Na2SO4 + SiF4↑ + 2HF↑ | |
| Na2[SiF6] + 2HF(ж) = 2Na(HF2) + SiF4↑ | кип |
| 4(NO)F + Si = SiF4 + 4NO | комн. |
| 4(NO)F + SiO2 = SiF4 + 2NO + 2NO2 | комн. |
| 4(NO2)F + 3Si = 3SiF4 + 4NO + 2SiO2 | комн. |
| 2PF5 + SiO2 = 2POF3 + SiF4 | 400° C |
| 4AsF3 + 3SiO2 = 3SiF4 + 2As2O3 | 100-150° C |
| 2SbF5 + SiO2 = SiF4 + 2SbOF3 | 250-300° C |
| 4ClF + SiO2 = SiF4 + 2Cl2 + O2 | комн. |
| 4ClF3 + 3SiO2 = 3SiF4 + 2Cl2 + 3O2 | комн. |
| 4ClF5 + 5SiO2 = 5SiF4 + 2Cl2 + 5O2 | комн. |
| 4BrF + SiO2 = SiF4 + 2Br2 + O2 | комн. |
| BrF3 + 3SiO2 = 3SiF4 + 2Br2 + 3O2 | комн. |
| 4BrF5 + 5SiO2 = 5SiF4 + 2Br2 + 5O2 | комн. |
| 4IF5 + 5SiO2 = 5SiF4 + 2I2O5 | 150-175°C |
| 2IF7 + SiO2 = SiF4 + 2IOF5 | комн. |
| 2XeF2 + SiCl4(ж) = SiF4 + 2Cl2↑ + 2Xe↑ | |
| 3XeF4 + SiO2 = 2XeOF4 + SiF4 + Xe | |
| 2XeF6(ж) + SiO2 = 2XeOF4 + SiF4 | |
| CrF4 + SiO2 = CrO2 + SiF4 | 350-400° C |
| 3ReF6 + 3SiO2 = 2ReO3F + ReF4 + 3SiF4 | до 300° C |
| 2ReF7(ж) + 3SiO2 = 2ReO3F + 3SiF4 | 50-70° C |
| 2Na[PF6] + 3SiO2 = 2NaPO3 + 3SiF4 | выше 650° C |
| Na2SiF6 = 2NaF + SiF4 | реакция уравнена без электронного баланса |
Химические свойства и применение фтора
Соли фтора используют в зубных пастах как микроэлементы, необходимые для организма. Также углеводороды с содержанием фтора используются в медицине как кровозаменители. Также фтор входит в другие сильные окислители, такие как фторид ксенона 6 (XeF6) или фторид азота 3 (NF3), последний является бесцветным ядовитым газом, растворимым в воде и относительно инертным при нормальных условиях, но при повышенной температуре является черезвычайно активным окислителем и сильным фторирующем агентом. Трифторид азота используют при получении углеводородов, в частности для тетрафторида углерода (CF4), т.к. при фторировании парафинов (алканов) на свету реакция течет по свободно-радикальному механизму и образуются несколько продуктов. Только у фтора нет оксидов, т.к. из-за его электроотрицательности (способность атома химического элемента, находясь в молекуле, притягивать к себе общие электронные пары, или, другими словами, оттягивать к себе электроны других атомов) в реакции с кислородом он образует фторид кислорода OF2 и диоксифторид O2F2. Многие вещества, не горящие при нормальных условиях способны гореть в среде фтора, например, вода воспламеняется даже при комнатной температуре в его среде, образуя при горении красивое синее пламя, свет которого схож с солями меди и кальция при том же самом горении. Или же огнеупорный асбест в среде фтора горит не хуже бумаги, притом заметим, что последняя в свою очередь моментально вспыхивает и сгорает в среде, напоминая горение нитроцеллюлозы (целлюлозы, обработанной азотной кислотой) в атмосфере воздуха.
Навигация
Варианты
expanded
collapsed
Ещё
expanded
collapsed
На других языках
- Afrikaans
- አማርኛ
- Aragonés
- العربية
- الدارجة
- مصرى
- Asturianu
- Azərbaycanca
- تۆرکجه
- Башҡортса
- Basa Bali
- Bikol Central
- Беларуская
- Беларуская (тарашкевіца)
- Български
- भोजपुरी
- বাংলা
- བོད་ཡིག
- Brezhoneg
- Bosanski
- Català
- Mìng-dĕ̤ng-ngṳ̄
- Cebuano
- ᏣᎳᎩ
- کوردی
- Corsu
- Čeština
- Чӑвашла
- Cymraeg
- Dansk
- Deutsch
- Ελληνικά
- English
- Esperanto
- Español
- Eesti
- Euskara
- Estremeñu
- فارسی
- Suomi
- Føroyskt
- Français
- Nordfriisk
- Furlan
- Frysk
- Gaeilge
- 贛語
- Gàidhlig
- Galego
- ગુજરાતી
- Gaelg
- 客家語/Hak-kâ-ngî
- Hawaiʻi
- עברית
- हिन्दी
- Fiji Hindi
- Hrvatski
- Kreyòl ayisyen
- Magyar
- Հայերեն
- Արեւմտահայերէն
- Interlingua
- Bahasa Indonesia
- Ido
- Íslenska
- Italiano
- 日本語
- La .lojban.
- ქართული
- Kabɩyɛ
- Қазақша
- ಕನ್ನಡ
- 한국어
- Kurdî
- Коми
- Kernowek
- Кыргызча
- Latina
- Lëtzebuergesch
- Limburgs
- Ligure
- Lombard
- Lingála
- Lietuvių
- Latviešu
- Māori
- Македонски
- മലയാളം
- Монгол
- ꯃꯤꯇꯩ ꯂꯣꯟ
- मराठी
- Кырык мары
- Bahasa Melayu
- မြန်မာဘာသာ
- Эрзянь
- Plattdüütsch
- नेपाली
- नेपाल भाषा
- Nederlands
- Norsk nynorsk
- Norsk bokmål
- Novial
- Occitan
- Livvinkarjala
- ଓଡ଼ିଆ
- ਪੰਜਾਬੀ
- पालि
- Polski
- Piemontèis
- پنجابی
- پښتو
- Português
- Runa Simi
- Română
- Armãneashti
- संस्कृतम्
- ᱥᱟᱱᱛᱟᱲᱤ
- Sicilianu
- Scots
- Srpskohrvatski / српскохрватски
- සිංහල
- Simple English
- Slovenčina
- Slovenščina
- Anarâškielâ
- Soomaaliga
- Shqip
- Српски / srpski
- Seeltersk
- Sunda
- Svenska
- Kiswahili
- Ślůnski
- தமிழ்
- తెలుగు
- Тоҷикӣ
- ไทย
- Tagalog
- Türkçe
- Татарча/tatarça
- ئۇيغۇرچە / Uyghurche
- Українська
- اردو
- Oʻzbekcha/ўзбекча
- Vepsän kel’
- Tiếng Việt
- Walon
- Winaray
- 吴语
- Хальмг
- ייִדיש
- Yorùbá
- 中文
- 文言
- Bân-lâm-gú
- 粵語
При недостаточности фтора в организме развивается
Недостаток микроэлемента может возникнуть по нескольким причинам:
- в результате нарушения обмена веществ;
- увлечение безбелковыми диетами;
- увлечение газированными сладкими напитками, где в избытке находятся пищевые красители;
- длительный прием лекарственных препаратов с большим содержанием магния;
- использование при искусственном вскармливании молочными смесями низкого качества.
Но основной причиной дефицита микроэлемента является недостаточное использование в рационе продуктов, обогащенных фтором.
https://youtube.com/watch?v=g3X0sRMBqkU%3F
Кариес
Уже давно замечено, что при недостаточности фтора в организме развивается кариес, а при избытке – флюороз. Чтобы понять, как влияет дефицит фтора на развитие кариеса, необходимо разобраться с противокариесным воздействием химического элемента. Механизм следующий: взаимодействуя с минеральными компонентами зубной ткани формируются нерастворимые соединения, которые выступают защитой для зубов.
Помимо этого, ингредиент осаждает фосфат кальция, который находится в слюне человека. А это благоприятствует минерализации зубов и приостанавливает кариесный процесс. Если фтора недостаточно, то все эти процессы нарушены. Это становится причиной позднего прорезывание зубов у малышей, а появления кариесного поражения молочных зубов.
Деформация осанки
Поскольку микроэлемент влияет на формирование костной ткани, то его недостаточное количество приводит к патологиям в костно-суставной системе. Появление болезненности в суставах, их деформация, неправильное формирование осанки – основные признаки нехватки не только кальция, являющегося строительным материалом для костей, но и фтора.
Физически в природе это вещество представляет из себя красивый минерал
Хрупкость костей и зубов
Дефекты в минерализации костной и зубной тканях приводит к их истончению. Кости становятся хрупкими, более подвержены переломам. После травм наблюдается замедленное восстановление и сращивание костей в местах переломов.
Остеопороз
Если дефицит фтора в детском организме проявляется в задержке окостенения, то у взрослых он способствует развитию остеопороза. Это заболевание, при котором в костных тканях образуются пустотелые поры. В группе риска находятся люди преклонного возраста, особенно женщины, у которых с возрастом понизилась костная масса. Причины такого явления разные. Но основная – недостаток кальция, который лучше усваивается при наличии фтора.
Продукты питания, богатые фтором
Среди продуктов питания в качестве источников фтора можно в первую очередь потреблять морскую рыбу и ламинарию (морскую капусту), а также есть креветок и моллюсков.
Средним содержанием фтора отличаются мясо, печень, молоко и его производные, а также яйца. Фтор присутствует в яблоках и других фруктах, в орехах, некоторых овощах и крупах.
Для того чтобы снабдить свой организм фтором, надо не только есть, но и пить. Так, известно, что фтор содержится в составе питьевой воды. В разных регионах страны концентрация минерала в воде различна.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
Фтор: История открытия
В силу своей высокой химической активности фтор отсутствует в природе в чистом виде, однако учёные задолго до его выделения пытались описать его. Таким образом, история открытия фтора растянулась на несколько столетий. Уже на грани XV–XVI веков при выплавке металлов и стекла использовался минерал CaF2– флюорит(лат. fluereозначает«течь»), или плавиковый шпат, в России его именовали также спалтом или спатом.
В XVII веке в стекольном производстве для получения узоров на посуде стала применяться плавиковая кислота в смеси со шпатом, природу которой пытались установить К. Шееле и Лавуазье. Последний и предположил в её составе наличие неизвестного науке химического элемента, который он назвал флюором(fluorum). Таким термином фтор и по сей день обозначается в европейских языках. А название «фтор» (от греч. «гибель, разрушение») принадлежит Амперу, который в 1810 г. сумел максимально точно предсказать свойства неведомого элементарного вещества. Над выделением чистого фтора в течение XIX века упорно бились многие химики. Около десятка из них даже погибли или получили серьёзное отравление в ходе экспериментов (Г. Дэви, братья Ноксы, Тенар и Гей-Люссак и др.), что словно бы подтверждает меткость смертоносного названия «фтор».
Наконец в 1886 году элементарный хлор в газообразной форме удалось получить французскому учёному Анри Муассану с помощью электролиза фторводорода, с применением сверхдорогого прибора из платины и иридия, так как выделенный газ был крайне агрессивен. Позже он опробовал аппарат для электролиза из меди, с которой фтор хоть и реагировал, но с образованием плёнки, не позволяющей этой реакции продолжаться.
Хроническое отравление[править | править код]
Это отравление называется флюорозом. У человека оно проявляется в основном остеосклерозом и пятнистым поражением эмали. Для остеосклероза характерно увеличение плотности костной ткани вследствие активации остеобластов и замещения гидроксиапатита более плотным фторапатитом. При рентгенографии выявляется поражение костей разной степени: от едва различимых изменений до выраженного утолщения длинных трубчатых костей, множественных экзостозов с обызвествлением связок, сухожилий и участков прикрепления мышц. В наиболее тяжелых случаях больной теряет трудоспособность и становится калекой.
Пятнистое поражение эмали
— хорошо известная патология, впервые описанная более 60 лет назад. В легких случаях на зубной эмали появляются непрозрачные меловидные пятна неправильной формы. В тяжелых случаях на поверхности зубов видны отдельные или сливающиеся темно-коричневые или черные углубления. Поражение возникает из-за нарушения способности клеток зуба к выработке эмали. Такое нарушение может иметь разные причины, и избыточное поступление фтора в организм — лишь одна из них.
Пятнистое поражение эмали — болезнь формирующихся зубов, на прорезавшиеся зубы избыток фтора уже не действует. Это один из первых видимых признаков флюороза у ребенка. Постоянное потребление воды с концентрацией фтора около 1 мг/л может привести лишь к очень незначительным изменениям эмали у 10% детей; при концентрации фтора 4—6 мг/л поражение зубов, причем гораздо более выраженное, отмечается почти у 100% детей.
Раньше в некоторых районах мира, например в г. Помпеи (Италия) или вблизи горы Пайкс-пик (штат Колорадо, США), где вода содержит большое количество фтора, выраженное поражение зубной эмали встречалось очень часто. В воде некоторых засушливых областей на юго-западе США фтор присутствует в очень высоких концентрациях, и у пасущегося там скота распространено поражение костей. В настоящее время федеральное законодательство США требует снижения уровня фтора в питьевой воде таких районов или использования других источников водоснабжения. Постоянное потребление воды с концентрацией фтора 4 мг/л со временем приводит к уменьшению массы компактного вещества кости и ускорению резорбции костной ткани (Sowers et al., 1991).
Как лучше употреблять?
Многие специалисты рекомендуют пить зеленый чай и с ним получать данный микроэлемент, но у него много противопоказаний. К тому же, это обезвоживающий напиток.

Летучему фтору вредна термическая обработка, а чай, который заварили кипятком, не является живым продуктом. Следует учитывать данную особенность интересующего компонента при готовке пищи.
Желательно употреблять источники в первозданном виде – сырыми. Не стоит класть их в алюминиевую посуду, которая приводит к потере фтора. К тому же большое количество кальция, фосфора, магния усложняет усвоение фтора.
https://youtube.com/watch?v=jujWuT42hNw
Избыток
Фтор в продуктах питания способен восполнить дефицит лишь при умеренном потреблении. Но компонент является ядовитым, если его поступает больше 20 мг. Передозировка считается опасной. Избыток приводит:
- к замедлению роста, прекращению деления клеток;
- общей слабости;
- сонливости;
- тошноте;
- кожной сыпи;
- полной потере голоса;
- судорогам;
- дрожи пальцев;
- кровоточивости десен;
- угнетению деятельности почек, печени, щитовидной железы.

Также происходит затруднение дыхания, понижение давления. Кости будут шершавыми, что приводит к мышечным и суставным болям. При отравлении фторидами появляется конъюнктивит, слезоточивость, пневмония, раздражение бронхов, кожи, сильные боли в животе, диарея.
При избытке фтора может возникнуть флюороз – заболевание, при котором на эмали возникают серо-коричневые пятна, деформация суставов, разрушение костной ткани. На коже образуются морщины, белые жесткие участки. Флюороз появляется при наличии 0,5 мг фтора на 1 кг массы.
Признаки передозировки возникают постепенно, поэтому при незначительном недомогании нужно посетить врача. Если медицинская помощь будет несвоевременной, лечение затягивается надолго.
Чтобы устранить избыток фторид-ионов, следует есть продукты, богатые кальцием, а также принимать препараты (глюконат кальция), слабительные (сульфат натрия). Средства с магнием не допускают усвоение минерала.
Если появилось отравление этим компонентом, следует вызвать рвоту и промыть желудок.
Дополнительная информация
Фториды Соединения фтора в ракетной технике Соединения фтора в медицине Категория:Соединения фтора
Фтор, Fluorum, F(9)
Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла. Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов. Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
По-видимому, химики и химики-ремесленники познакомились с плавиковой кислотой не позднее XVII в. В 1670 г. нюрнбергский ремесленник Шванхард использовал плавиковый шпат в смеси с серной кислотой для вытравливания узоров на стеклянных бокалах. Однако в то время природа плавикового шпата и плавиковой кислоты была совершенно неизвестна. Полагали, например, что протравливающее действие в процессе Шванхарда оказывает кремневая кислота. Это ошибочное мнение устранил Шееле, доказав, что при взаимодействии плавикового шпата с серной кислотой кремневая кислота получается в результате разъедания стеклянной реторты образующейся плавиковой кислотой. Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Лавуазье признал радикал плавиковой кислоты (radical fluorique) простым телом и включил его в свою таблицу простых тел. В более или менее чистом виде плавиковая кислота была получена в 1809 r. Гей-Люссаком и Тенаром путем перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте. При этой операции оба исследователя получили отравление. Истинную природу плавиковой кислоты установил в 1810 г. Ампер. Он отверг мнение Лавуазье о том, что в плавиковой кислоте должен содержаться кислород, и доказал аналогию этой кислоты с хлористоводородной кислотой. О своих выводах Ампер сообщил Дэви, который незадолго до этого установил элементарную природу хлора. Дэви полностью согласился с доводами Ампера и затратил немало усилий на получение свободного фтора электролизом плавиковой кислоты и другими путями
Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.)
Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Многочисленные попытки выделить свободный фтор в XIX в. не привели к успешным результатам. Лишь в 1886 г. Муассану удалось сделать это и получить свободный фтор в виде газа желто-зеленого цвета. Так как фтор является необычайно агрессивным газом, Муассану пришлось преодолеть множество затруднений, прежде чем он нашел материал, пригодный для аппаратуры в опытах со фтором. U-образная трубка для электролиза фтористо- водородной кислоты при 55°С (охлаждаемая жидким хлористым метилом) была сделана из платины с пробками из плавикового шпата. После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение. Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.
Химические свойства
Фторид натрия — это твердое кристаллическое вещество белого цвета. Температура плавления — 992°C, кипения — 1700°C. Не горюч. Так как химическая связь у фторида натрия – ионная, он хорошо растворим в воде, а еще лучше — во фтороводороде. Почти не растворим в органических растворителях. Не гигроскопичен и не образует кристаллогидратов.
В водных растворах фторид натрия диссоциирует и образует комплексное соединение.
https://www.youtube.com/watch?v=ytcreatorsru
NaF 4H2O → F-
Предлагаем ознакомиться: Вреден ли крем Фиттидент для здоровья
При взаимодействии с плавиковой кислотой образуется дифторгидрат. Но при избытке фтороводорода могут образовываться иные комплесксные соединения, которые называются гидрофториды натрия. Их состав может быть разным в зависимости от соотношения реагентов.
Как видно из химической формулы, фторид натрия — это типичная соль, поэтому он вступает в реакции обмена с другими солями, если в результате реакции образуется осадок или газ. При взаимодействии с кислотами выделяется газообразный фтороводород. А с гидроксидом лития образуется осадок фторида лития.
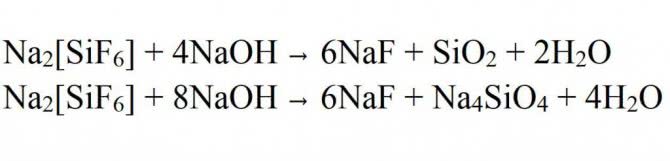
История открытия
В 1670 г. немецкий химик К.Шванквард поместил в сосуд из флюорита серную кислоту и накрыл его стеклянной крышкой. Тогда он заметил, что выделенные газы разъели стекло. В 1771 году ученые провели опыт, в результате которого получили неизвестную кислоту. Ее назвали плавиковой. Этот период и считается моментом открытия фтора.
В то время ученые уже знали минерал, который снижал температуру плавления руд. А флюором называли его основу. В 1779 г. кислоту получили в металлическом сосуде. Через 30 лет это стало возможным сделать и без воды. В 1810 г. физик Ампер выдвинул идею, что кислота должна содержать еще один элемент. Это предположение и обозначило фтор, как химический компонент.
Попытки получения чистого вещества не увенчались успехом. Ученые из разных стран проводили бесконечные опыты. Но, как известно, фтор – токсичное вещество, поэтому результаты часто становились трагичными. Получить его пытались из фторидов серебра и свинца. Тогда ученые отравились выделенными газами.
Лишь в 1886 г. Анри Муассан отделил элемент в свободном виде. Им проводились опыты выделения из фтороводорода без присутствия воды примесей гидрофторида калия. Ему удалось завладеть несколькими пузырьками газообразного вещества. Платину заменили медью. Это и способствовало образованию пленки, за которой размещался фтор.
На данный момент процесс выделения на электродах составных частей является основным для получения элемента. С 1919 г. для этого использовали расплавы бифторидов – веществ, проводящих ток на ионы. В качестве удешевления производства стали применяться медь, никель, сталь и графит.