Фосфорная кислота H3PO4
В степени окисления +5 фосфор способен образовывать определенные кислоты:
- орто-фосфорную H3PO4;
- мета-фосфорную HPO3;
- пиро-фосфорную H4P2O7.
Во многих случаях в химии фосфорной кислотой называют ее водный раствор с концентрацией 85%. Такая жидкость напоминает сироп и не обладает запахом. Соединение характеризуется высокой степенью растворимости в этаноле и других растворителях. Строение фосфорной кислоты выражает структурная формула:
При стандартных условиях, то есть температуре 25 °C и давлении 1 атм, фосфорная кислота характеризуется классом опасности Н290, Н314.
Фосфорная кислота не обладает специфическим токсическим эффектом. Показатели системной токсичности вещества достаточно невысокие. Раствор фосфорной кислоты оказывает раздражающее воздействие на органы зрения и дыхания, слизистые оболочки. Если концентрация соединения превышает 10%, смесь характеризуется раздражающим эффектом, а при 25% содержания вещества раствор вызывает коррозию.
Диссоциация фосфорной кислоты в водных растворах протекает ступенчато:
H3PO4⇄H++H2PO4-,
H2PO4-⇄H++HPO42-,
HPO42-⇄H++PO43-.
С каждой новой ступенью диссоциация ослабевает. Полного распада на ионы у фосфорной кислоты не наблюдается. Вещество характеризуется меньшей активностью в процессе химического взаимодействия, по сравнению с серной, азотной, соляной кислотами.
Обзор кислородных соединений
При горении твёрдого фосфора образуется ряд веществ, на состав которых влияет концентрация кислорода в окружающем воздухе. Теоретически существует вероятность ряда метастабильных оксидов с общей формулой P4On, где коэффициент n лежит в интервале от 6 до 9. При диссоциации таких веществ образуются молекулы PO, которые в составе паров обнаруживаются только спектроскопическими методами анализа.
Список номенклатуры соединений, которые индивидуально выделяются, но не имеют широкого практического применения, выглядит так:
- Монооксид тетрафосфора P4O. Образуется при сжигании фосфора в недостатке воздуха или кислорода. Имеет вид красно-бурых кристаллов с плотностью 1,891 грамм/куб. сантиметр, не растворяется в воде. Воспламеняется при 280 °C, при нагревании в атмосфере инертного газа разлагается на P и P2O5.
- Диоксид тетрафосфора P4O2 (P2O) существует в виде димера. Получается продуванием подогретого до 60 °C воздуха или чистого кислорода через раствор легковоспламеняющегося белого фосфора в тетрахлорметане CCl4. Его жёлто-красные кристаллы при атмосферном давлении устойчивы до 100 °C, а в условиях вакуума — до 135 °C. При нагревании разлагается и выделяет P, не растворяется в H2O (воде), C2H5OH (этаноле) и C3H6O (ацетоне), на воздухе окисляется до H3PO3. Высокие восстановительные способности по отношению к ионам Fe3+, Cu2+, Ag+ используются для очистки от примесей железа в экстракционном способе получения H3PO4.
- Октаоксид тетрафосфора P4O8. Образуется при низкотемпературном горении фосфора в ограниченном количестве воздуха как белые хлопья или кристаллы. В газообразном состоянии имеет вид димеров P8O16, в твёрдой фазе присутствуют агрегаты — от мономеров до тримеров. Вещество сохраняет устойчивость при температурах до 100 °C, возгоняется при 180 °C, при нагревании выше 400 °C в чистом кислороде окисляется до P4O10. Кристаллы расплываются на воздухе, хорошо растворяются в воде, но стойки к органическим растворителям. Водные растворы содержат равное количество молей H3PO3 и HPO3 и с трудом окисляются до H3PO4.
- Триоксид (пероксид) фосфора PO3. Некоторые данные сообщают о существовании форм P2O6 или P4O11. Твёрдое вещество имеет фиолетовый цвет, обусловленный примесями. Образуется из паров P4O10 в условиях вакуума при воздействии электрического разряда и сохраняет стабильность до 150 часов при отсутствии влажности и нормальной температуре. Разлагается с выделением O2 при 127 °C, при гидратации даёт пероксофосфорную или пероксопирофосфорную кислоту, вступает в реакции с оксидами многих металлов с образованием солей — пероксофосфатов.
Наиболее устойчивы, даже в парах остаются димерами и имеют для нужд химии практическую ценность Р2О3 — трёхвалентный оксид фосфора и Р2O5 — пятивалентный оксид фосфора. Физические свойства и основные характеристики приведены в таблице:
| Наименование систематическое | Традиционное название | Химическая формула | Молярная масса, грамм/моль | Плотность, грамм/куб. см | Состояние |
| оксид фосфора (III) | фосфористый ангидрид или гексаоксид тетрафосфора | P2O3 | 219,89 | 2,135 | белые хлопья или кристаллы |
| оксид фосфора (V) | фосфорный ангидрид или пентаоксид фосфора | P2O5 | 141,94 | 2.39 | белый порошок |
История
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для его добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.
Картина Джозефа Райта «Алхимик, открывающий фосфор» (1771 год), предположительно описывающая открытие фосфора Хеннигом Брандом.
Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Более усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Аморфную аллотропную модификацию фосфора — красный фосфор Pn — выделил, нагревая белый фосфор без доступа воздуха, А. Шрёттер в середине XIX в.
Химические свойства
Как мы писали выше, фосфор занимает 15 место в периодической таблице Менделеева и входит в одну группу с азотом, мышьяком и сурьмой. Хотя на валентном уровне он и имеет целых 5 электронов, однако 5 связей образуются довольно редко.

Фосфор – очень химически активный элемент, особенно белый фосфор. Как следствие он может вступать в самые разнообразные химические реакции, выступая как в качестве окислителя (с элементами, расположенными ниже и левее в таблице Менделеева), так и восстановителя (с элементами, расположенными выше и правее в таблице Менделеева).
При взаимодействии с кислородом воздуха образуются оксиды – ангидриды соответствующих кислот:
4P +3O2 > 2P2O3
4P + 5O2 > 2P2O5
При взаимодействии фосфора с галогенами образуются галогениды с общей формулой PHal3 и PHal5:
2P + 3Cl2 > 2PCl3
2P + 5Cl2 > 2PCl5
При взаимодействии фосфора с серой образуются сульфиды:
2P + 3S > P2S3
2P + 5S > P2S5
При взаимодействии с металлами фосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P + 3Ca > Ca3P2
2P + 3Mg > Mg3P2
Элементы: Светоносный фосфор
Дата: 17.07.2019
Фосфор был открыт случайно немецким алхимиком Хеннигом Брандом в 1669 году. Бранд, как и многие его коллеги тех времён, пытался получить т.н. великий эликсир – некий реактив, необходимый для превращения обычных металлов в золото. Бранд полагал, что золото можно выделить из мочи. Его предположения основывались на сходстве цветов золота и исходного вещества. Испаряя биологическую жидкость и нагревая сухой остаток до красного каления, над осадком поднимались светящиеся пары белого вещества, которое ярко горело и светилось в темноте. Бранд сначала назвал это вещество «холодный огонь», потом — «чудотворный носитель света» (лат. phosphorus mirabilis ). Позднее укрепилось название «фосфор», от греческих слов «φώς» — свет и «φέρω» — несу. Фосфор стал первым элементом, открытым со времён античности.
В Таблице Менделеева фосфор имеет атомный номер 15 и обозначается символом Р (от Phosphorus). Это многоликий элемент и в разных условиях он ведет себя по-разному. Его многоликость связана со способностью находиться в нескольких аллотропных (от др.-греч. ἄλλος – другой) модификациях.
В настоящее время известно 11 аллотропных состояний фосфора, из которых четыре — основные и наиболее хорошо изучены: белый, красный, желтый, чёрный. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, диэлектрик. Именно эту разновидность открыл Бранд в 17 веке. Красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется. Чёрный фосфор химически инертен, хорошо проводит электрический ток. Жёлтый фосфор – сильно ядовитое огнеопасное кристаллическое вещество, не растворимое в воде — от светло-жёлтого до тёмно-бурого цвета.

Открытие фосфора Хеннигом Брандом. Картина британского живописца Джозефа Райта «Алхимик, открывающий фосфор» ,1771 год.

Аллотропные модификации фосфора: белый, красный, жёлтый, чёрный.
В свободном состоянии в природе фосфор не встречается. Он входит в состав 180 различных минералов, главными из которых являются апатит Ca5(PO4)3 (F,Cl,OH) и его разновидности. Важнейшим сырьём для производства минеральных удобрений являются т.н. фосфориты – осадочные горные породы, состоящие более чем на 50% из фосфатных минералов.

Кристаллы апатита (до 10см). Месторождение Слюдянка, Восточная Сибирь.
Содержание фосфора в земной коре составляет 0,1 % по массе. Это двенадцатый по распространённости элемент на Земле, и довольно распространённый элемент Солнечной системы. Он типичен для каменных и железо-каменных метеоритов, где его концентрации достигают 0,9 % по массе. В лунном грунте его содержания составляют 0,02-0,3%.
По разведанным запасам фосфатов Россия занимает четвёртое место в мире после США, Марокко и Китая. Основной источник фосфорного сырья в России – Кольский полуостров, где в пределах Хибинского массива разведано 10 крупных месторождений апатито-нефелиновых руд.
Применение фосфора
Человек «приручил» фосфор как в мирных, так и в военных целях. Вещество используют для производства фосфорной кислоты, которую применяют для удобрений. Раньше она широко использовалась для окраски шерсти, изготовления фоточувствительных эмульсий.
Белый фосфор применяется не очень широко. Основная его ценность в горючести. Так, вещество используют для зажигательных боеприпасов. Этот вид оружия был актуален во время обеих Мировых воин. Его применяли в войне в Газе в 2009 году, а также в Ираке в 2016 году.
Красный фосфор используется более широко. Из него делают топливо, смазочные материалы, взрывчатые вещества и головки спичек. Различные соединения фосфора используют в промышленности в средствах для смягчения воды, добавляют в пассиваторные средства, чтобы защитить металл от коррозии.
[править] Распространение в природе
Фосфор достаточно распространенный элемент (0,08 % массы земной коры). Концентрация в морской воде 0,07 мг/л. В природе он встречается исключительно в связанном состоянии. Важнейшими природными соединениями фосфора являются минералы фосфорит Са3(PO4)2 и апатит, который в своем составе содержит, кроме фосфата кальция, его хлорид.
Богатые месторождения апатита является на Кольском полуострове, а также в южном Казахстане (горы Каратау), на Урале, в Эстонии, Ленинградской и Московской областях Российской Федерации, на Украине и в других местах.
Фосфор является также постоянной составной частью живых организмов — растений и животных. Особенно значительные его количества содержатся в костях животных (и человека) в виде фосфата кальция. Кроме того, фосфор входит в состав нуклеиновых кислот и белков.
Как справиться с последствиями
Прежде чем приступать к действиям, направленным на спасение, человека, необходимо убедиться в том, что его причиной действительно являются фосфорные бомбы и содержащиеся в них вещества. Такие ожоги имеют специфический запах чеснока, кожа вокруг них дымится и обугливается.

Первым делом на потушенный ожог накладывается асептическая повязка, чтобы предупредить воспаление и попадание инфекции. Далее принимаются все меры для предупреждения болевого шока с последующей эвакуацией человека из зоны поражения. В холодное время года не рекомендуется снимать с пострадавшего одежду, чтобы не усилить шок.
Применение каких-либо лекарств без предварительного анализа состояния человека допустимо лишь в том случае, если медик точно знает, что лекарство вероятнее поможет, чем навредит. Однако специалисты настоятельно рекомендуют не оказывать помощь пострадавшему, если человек не знает, что делать с подобными травмами.
Свойства атома фосфора:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 30,973762(2) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p3 |
| 203 | Электронная оболочка |
K2 L8 M5 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 98 пм |
| 205 | Эмпирический радиус атома* | 100 пм |
| 206 | Ковалентный радиус* | 107 пм |
| 207 | Радиус иона (кристаллический) | P3+
58 (6) пм, P5+ 52 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 180 пм |
| 209 | Электроны, Протоны, Нейтроны | 15 электронов, 15 протонов, 16 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 15-ая группа (по старой классификации – главная подгруппа 5-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
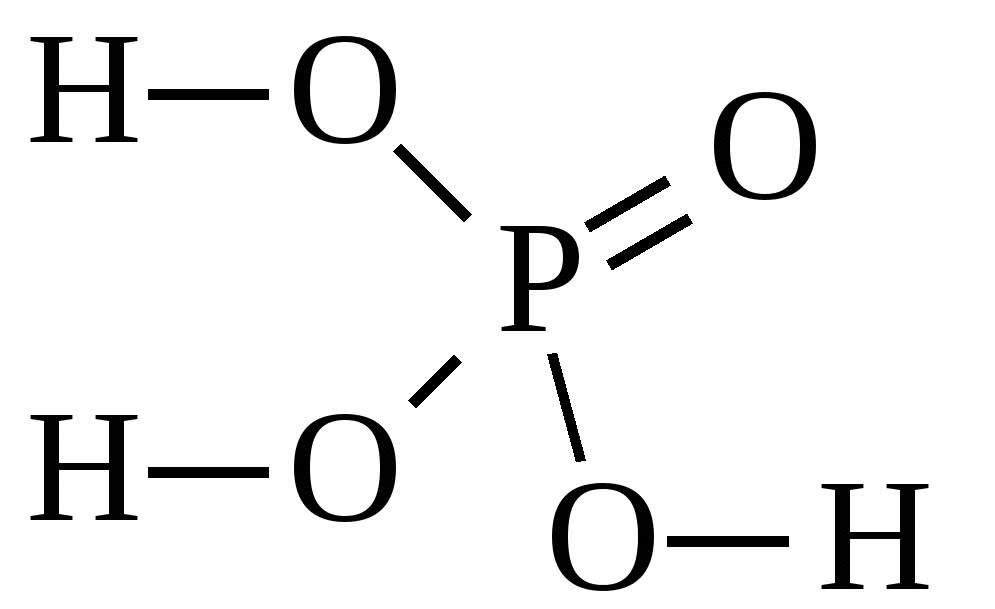
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
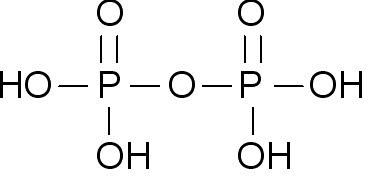
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Атом и молекула фосфора. Формула фосфора. Строение атома фосфора:
Фосфор (лат. Phosphorus, от др.-греч. φῶς – “свет” и φέρω – “несу”; φωσφόρος – “светоносный”) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением P и атомным номером 15. Расположен в 15-й группе (по старой классификации – главной подгруппе пятой группы), третьем периоде периодической системы.
https://youtube.com/watch?v=zsG1SWUeFE0
Фосфор – неметалл. Относится к группе пниктогенов.
Фосфор обозначается символом P.
Как простое вещество фосфор при нормальных условиях представляет собой твёрдое вещество белого, красного, фиолетового, черного или синего цвета. Все модификации фосфора различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный.
Молекула фосфора одноатомна.
Химическая формула фосфора P.
Электронная конфигурация атома фосфора 1s2 2s2 2p6 3s2 3p3. Потенциал ионизации (первый электрон) атома фосфора равен 1011,81 кДж/моль (10,486 686 (15) эВ).
Строение атома фосфора. Атом фосфора состоит из положительно заряженного ядра (+15), вокруг которого по трем оболочкам движутся 15 электронов. При этом 10 электронов находятся на внутреннем уровне, а 5 электронов – на внешнем. Поскольку фосфор расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома фосфора на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали – три неспаренных электрона. В свою очередь ядро атома фосфора состоит из 15 протонов и 16 нейтронов. Фосфор относится к элементам p-семейства.
Радиус атома фосфора (вычисленный) составляет 114 пм.
Атомная масса атома фосфора составляет 30,973762(2) а. е. м.
Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Фосфор содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Белый фосфор очень ядовит.
Химические свойства
Фосфин сильно отличается от своего аналога, аммиака. Его химическая активность выше, он плохо растворим в воде, как основание значительно слабее. Последнее объясняется тем, что связи H−P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:
- 2 PH3 →t 2 P + 3 H2
На воздухе горит согласно уравнению:
- PH3 + 2 O2 → H3PO4
Проявляет сильные восстановительные свойства:
- PH3 + 3 H2SO4 → H2(PHO2) + 3 SO2 ↑ + 3 H2O
- PH3 + 8 HNO3 → H3PO4 + 8 NO2 ↑ + 4 H2O
- PH3 + 2 I2 + 2 H2O → H(PH2O2) + 4 HI
В связи с тем, что:
- 4 H2(PHO3) →170−200∘C PH3 ↑ + 3 H3PO4
то возможно протекание следующей реакции:
- PH3 + 4 H2SO4 →200∘C H3PO4 + 4 SO2 ↑ + 4 H2O
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.
- PH3 + HCl →30∘C PH4Cl
- PH3 + HI → PH4I
Соли фосфония, как и сам фосфин, являются сильными восстановителями.
Роль в растении
Биохимические функции
Окисленные соединения фосфора необходимы всем живым организмам. Ни одна живая клетка не сможет существовать без них.
В растениях фосфор содержится в органических и минеральных соединениях. При этом, содержание минеральных соединений составляет от 5 до 15 %, органических – 85–95 %. Минеральные соединения представлены калиевыми, кальциевыми, аммонийными и магниевыми солями ортофосфорной кислоты. Минеральный фосфор растений – запасное вещество, резерв для синтеза фосфорсодержащих органических соединений. Он увеличивает буферность клеточного сока, поддерживает тургор клетки и другие не менее важные процессы.
Органические соединения – нуклеиновые кислоты, аденозинфосфаты, сахарофосфаты, нуклеопротеиды и фосфатопротеиды, фосфатиды, фитин.
На первом месте по важности для жизнедеятельности растений стоят нуклеиновые кислоты (РНК и ДНК) и аденозинфосфаты (АТФ и АДФ). Данные соединения участвуют во многих процессах жизнедеятельности растительного организма: синтезе белков, энергетическом обмене, передаче наследственных свойств
Нуклеиновые кислоты
P2O5 в нуклеиновых кислотах содержится около 20 %. Данные кислоты – неотъемлемая часть всех тканей и органов растений любой растительной клетки. В листьях и стеблях нуклеиновые кислоты составляют 0,1–1,0 % сухой массы.
Аденозинфосфаты
Особая роль фосфора в жизни растений заключается в участии в энергетическом обмене растительной клетки. Главная роль в данном процессе принадлежит аденозинфосфатам. В их составе присутствуют остатки фосфорной кислоты, связанные макроэргическими связями. При гидролизе они способны выделять значительное количество энергии.
Они представляют собой своеобразный аккумулятор энергии, поставляя ее по мере необходимости для осуществления всех процессов в клетке.
Различают аденозинмонофосфат (АМФ), аденозиндифосфат (АДФ) и аденозинтрифосфат (АТФ). Последний по запасам энергии значительно превосходит два первых и занимает ведущую роль в энергетическом обмене. Он состоит из аденина (пуринового основания) и сахара (рибозы), а также трех остатков ортофосфорной кислоты. Синтез АТФ осуществляется в растениях в процессе дыхания.
Фосфатиды
Фосфатиды, или фосфолипиды – сложные эфиры глицерина, высокомолекулярных жирных кислот и фосфорной кислоты. Они входят в состав фосфолипидных мембран, регулируют проницаемость клеточных органелл и плазмалеммы для различных веществ.
Цитоплазма всех растительных клеток содержит представителя группы фосфатидов лецитин. Это производное диглицеридфосфорной кислоты, жироподобное вещество, имеющее в составе 1,37 % P2O5.
Сахарофосфаты
Сахарофосфаты, или фосфорные эфиры сахаров, присутствуют во всех тканях растений. Известно более десятка соединений данного типа. Они выполняют важную роль в процессах дыхания и фотосинтеза в растениях. Образование сахарофосфатов носит название фосфорилирование. Содержание сахарофосфатов в растении, в зависимости от возраста и условий питания, варьирует от 0,1 до 1,0 % сухой массы.
Фитин
Фитин – это кальциево-магниевая соль инозитфосфорной кислоты, содержит 27,5 % P2O5. Он занимает первое место по содержанию в растениях среди других фосфорсодержащих соединений. Фитин присутствует в молодых органах и тканях растений, особенно много его в семенах, где он служит запасным веществом и используется проростками в процессе прорастания.
Примечания
- Phosphorus: electronegativities — www.webelements.com/phosphorus/electronegativity.html (англ.). WebElements.
- Sulfur and Phosphorus Compounds — www.cem.msu.edu/~reusch/VirtualText/special2.htm (англ.).
- Редкол.:Зефиров Н. С. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Большая Российская энциклопедия, 1999. — Т. 5. — С. 145.
- J.P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др. Химия = Chemie. — М.: Химия, 1989. — С. 351. — ISBN 5-7245-0360-3
- УНИАН — здоровье — Что происходит с фосфором? — health.unian.net/rus/detail/185459
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Фосфор |
| 102 | Прежнее название | |
| 103 | Латинское название | Phosphorus |
| 104 | Английское название | Phosphorus |
| 105 | Символ | P |
| 106 | Атомный номер (номер в таблице) | 15 |
| 107 | Тип | Неметалл |
| 108 | Группа | Пниктоген |
| 109 | Открыт | Хенниг Бранд, Германия, 1669 г. |
| 110 | Год открытия | 1669 г. |
| 111 | Внешний вид и пр. | Твёрдое вещество белого, красного, фиолетового, черного или синего цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | Несколько аллотропных модификаций фосфора, в т.ч.:
— белый фосфор (α-фосфор (α-форма) с кубической объёмно-центрированной кристаллической решёткой и β-фосфор (β-форма) с гексагональной кристаллической решёткой), — красный фосфор, — фиолетовый фосфор, — чёрный фосфор, — синий фосфор |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | Фосфорен |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,099 % |
| 120 | Содержание в морях и океанах (по массе) | 7,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0007 % |
| 122 | Содержание в Солнце (по массе) | 0,0007 % |
| 123 | Содержание в метеоритах (по массе) | 0,11 % |
| 124 | Содержание в организме человека (по массе) | 1,1 % |
Испарение в жизни
И действительно: чего в этой жизни только не испаряется — мы встречаемся с этим каждый день. Давайте узнаем, зачем этот процесс вообще нужен, и как люди научились извлекать из него пользу.
Испарение в организме человека и животных
Выше мы разбирали вопрос, почему если облиться теплой водой, нам все равно станет холодно. По этому же принципу работает ощущение холода после того, как мы вспотели — в какой-то момент нам становится холодно.
Само потоотделение — важный процесс терморегуляции организма. Если мы достигаем высокой температуры (из-за внешних воздействий или же из-за болезни), то организм стремится себя охладить, чтобы не умереть из-за превращения белков в нашем организме в яичницу.
Пот выделяется через поры кожи, а затем испаряется — все это позволяет нашему организму быстро избавиться от лишней энергии, охладить тело и нормализовать температуру.
|
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой и «скинуть» избыточное тепло, но при высокой влажности пот не может испариться. При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно. А при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве. |
У животных этот механизм работает схожим образом. Но, например, собакам испарения с кожи недостаточно, поэтому они часто открывают пасть, высовывают язык и дышат порой ну очень смешно
Именно гортань и язык собаки идеально подходят для испарения влаги и охлаждения тела животного.
Испарение у растений
Удивительно, но у растений механизм испарения тоже работает схожим образом. Растения очень любят воду, поэтому домашние растения мы поливаем, а в пустынях их просто нет.
Ту воду, которую цветы поглотили, они могут испарять, чтобы не перегреться под жарким солнцем. Да, вода нужна, чтобы растения питались, но в жаркие дни еще и для температурной саморегуляции. Поэтому не забывайте поливать цветы, а в очень жаркие дни делайте это еще интенсивнее.
Испарение в природе и окружающей среде
Процесс испарения напрямую связан с круговоротом воды в природе. Именно круговоротом воды в природе обеспечивается жизнь на Земле — так как влага разносится по всему миру, растения в дикой природе способны жить без наших попыток полить большую пальму из леечки.
Испарение воды с поверхности рек, озер, морей и океанов создает дождевые тучи, которые затем, проливаясь дождем, поливают растения и деревья. Многие дождь не любят, мол, он мокрый, мерзкий и затекает в ботинки, но он очень нужен засушливым регионам — Северной Африке или Центральной Индии, которые часто страдают от засухи.
Испарение в промышленности и быту
С бытом совсем все просто: мы сушим вещи, готовим еду, покупаем увлажнители воздуха или размазываем разлитую лужу по полу.

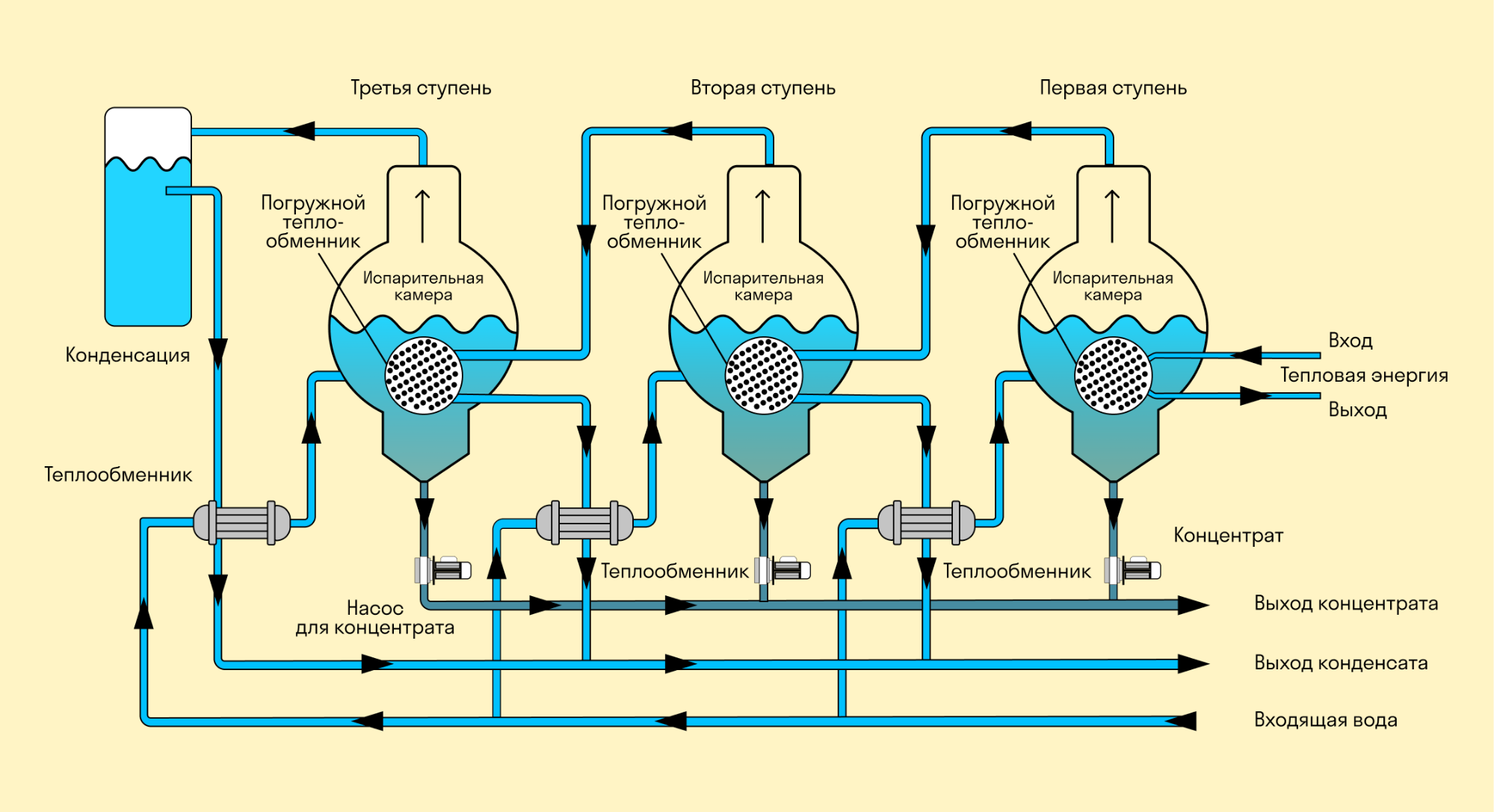
В случае с промышленностью для нас все не так очевидно. Промышленная техника, работающая на основе испарения, разрабатывается по схожей схеме: в ней всегда максимально увеличена площадь поверхности жидкости, чтобы испарение шло интенсивно.
Например, испаритель, изображенный на схеме, состоит из совокупности соединенных между собой испарителей. В основе его действия — пар, полученный в одной ступени, который используют в качестве источника тепла для следующей ступени. По мере того, как температура уменьшается от одной ступени к другой, вакуум увеличивается, так что температура кипения становится ниже и испарение поддерживается. Он предназначен для того, чтобы очистить воду от отходов.
План:
- Введение
- 1 История
- 2 Происхождение названия
- 3 Получение
-
4 Физические свойства
- 4.1 Белый фосфор
- 4.2 Жёлтый фосфор
- 4.3 Красный фосфор
- 4.4 Чёрный фосфор
- 4.5 Металлический фосфор
-
5 Химические свойства
- 5.1 Взаимодействие с простыми веществами
- 5.2 Взаимодействие с водой
- 5.3 Взаимодействие со щелочами
- 5.4 Восстановительные свойства
-
6 Применение
- 6.1 Элементарный фосфор
- 6.2 Соединения фосфора в сельском хозяйстве
- 6.3 Соединения фосфора в промышленности
- 6.4 Фосфатные связующие
-
7 Биологическая роль соединений фосфора
- 7.1 Токсикология элементарного фосфора
- 7.2 Токсикология соединений фосфора
Примечания
Международные соглашения, определяющие порядок применения фосфорных боеприпасов
Разработка, испытания, транспортировка, торговля, применение и утилизация фосфорных боеприпасов производятся с учётом ряда международных соглашений и договоров, среди которых:
На международном уровне попытки ограничить использование химического и зажигательного оружия в ходе войн и военных конфликтов были предприняты на рубеже 1920-х-1930-х годов в ходе работы конференции по сокращению и ограничению вооружений Лиги наций . Намерение было зафиксировано в тексте резолюции конференции, разработанной 9 июля 1932 года и принятой 23 июля 1932 года. Однако осложнение международной обстановки в середине 1930-х годов стало причиной прекращения работы конференции в январе 1936 года .






