Общая характеристика

Химики описывают йод как черные/серые кристаллы, имеющие характерный фиолетовый отблеск, резкий запах. При их нагревании выделяются пары фиалкового цвета, благодаря чему элемент и получил свое название.ИНТЕРЕСНО! Открытие химического вещества датируется еще 18 столетием, хотя всем известный медицинский йодный раствор стали использовать намного позже.
В периодической таблице Менделеева элемент обозначается как I (от Iodum), имеет 53-ий атомный номер, относится к активным неметаллам и группе галогенов.
Химические свойства элемента подобны Хлору, только вот добывают его из морских водорослей/источников нефтяного характера, получая в результате характерные кристаллы с металлическим блеском/резким запахом.
Также вещество оказалось летучим даже в условиях комнатной температуры. При минимальном нагревании может возгореться и начать испаряться. Пары при этом имеют яркий фиолетовый оттенок.
Общая характеристика йода
Это довольно активный микроэлемент, относящийся к неметаллам. В периодической таблице Менделеева он находится в группе галогенов вместе с хлором, бромом и фтором. Обозначается йод символом I и имеет порядковый номер 53. Название этот микроэлемент получил в 19 веке из-за фиолетового цвета паров. Ведь по-гречески йод переводится, как «фиалковый, фиолетовый».
Именно так был обнаружен йод. Химик Бернар Куртуа, работающий на фабрике по производству селитры обнаружил это вещество случайно. Кот перевернул пробирку с серной кислотой, и она попала на золу водорослей, из которой тогда получали селитру. При этом выделился газ, имеющий фиолетовый цвет. Это заинтересовало Бернара Куртуа, и он начал изучать новый элемент. Так в начале 19 века стало известно о йоде. В середины 20 века этот элемент химики стали называть «йодом», хотя до сих пор более распространено старое обозначение.

Свойства йода (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Йод |
| 102 | Прежнее название | |
| 103 | Латинское название | Iodum |
| 104 | Английское название | Iodine |
| 105 | Символ | I |
| 106 | Атомный номер (номер в таблице) | 53 |
| 107 | Тип | Неметалл |
| 108 | Группа | Галоген |
| 109 | Открыт | Бернар Куртуа, Франция, 1811 г. |
| 110 | Год открытия | 1811 г. |
| 111 | Внешний вид и пр. | Кристаллы чёрно-серого цвета с фиолетовым металлическим блеском. Легко образует фиолетовые пары, обладающие резким запахом |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,000049 % |
| 120 | Содержание в морях и океанах (по массе) | 6,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | 0,000025 % |
| 124 | Содержание в организме человека (по массе) | 0,00002 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 126,90447(3) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5 |
| 203 | Электронная оболочка |
K2 L8 M18 N18 O7 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 115 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 139 пм |
| 207 | Радиус иона (кристаллический) | I–
206 (6) пм, I 5+ 109 (6) пм, I 7+ 67 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 198 пм |
| 209 | Электроны, Протоны, Нейтроны | 53 электрона, 53 протона, 74 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 17-ая группа (по старой классификации – главная подгруппа 7-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0, +1, +3, +4, +5, +6, +7 |
| 302 | Валентность | I, III, V, VII |
| 303 | Электроотрицательность | 2,66 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1008,39 кДж/моль (10,451260(25) эВ) |
| 305 | Электродный потенциал | I2 + 2e– → 2I–, Eo = +0,536,
I3– + 2e– → 3I–, Eo = +0,545 |
| 306 | Энергия сродства атома к электрону | 295,2 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 4,933 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело)
4,866 г/см3 (при 60 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | 113,7 °C (386,85 K, 236,66 °F) |
| 403 | Температура кипения* | 184,3 °C (457,4 K, 363,7 °F) |
| 404 | Температура сублимации* | При нагревании при атмосферном давлении |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 15,52 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 41,57 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 54,44 Дж/(K·моль) |
| 411 | Молярный объём | 25,7 см³/моль |
| 412 | Теплопроводность | 0,449 Вт/(м·К) (при стандартных условиях),
0,45 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки |
Орторомбическая |
| 513 | Параметры решётки | a = 7,18 Å, b = 4,71 Å, c = 9,81 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Cmca |
| 517 | Номер пространственной группы симметрии | 64 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7553-56-2 |
Примечание:
205* Эмпирический радиус атома йода согласно составляет 136 пм.
206* Ковалентный радиус йода согласно и составляет 139±3 пм и 133 пм соответственно.
401* Плотность йода согласно и составляет 4,93 г/см3 (при 25 °C и иных стандартных условиях, состояние вещества – твердое тело) и 4,94 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления йода согласно и составляет 113,5 °С (386,65 K, 236,3 °F) и 114 °С (387,15 K, 237,2 °F) соответственно. Жидкий йод согласно можно получить, нагревая его под давлением.
403* Температура кипения йода согласно и составляет 184,35 °C (457,5 K, 363,83 °F) и 185,5 °С (458,65 K, 365,9 °F) соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) йода согласно составляет 41,95 кДж/моль.
Правильная диета
Самый простой метод компенсировать недостаток йода — придерживаться здоровой диеты. Продукты, богатые йодом, в основном включают морскую рыбу (треска, минтай, тунец, макрель, лосось, сельдь, камбала, радужная форель). Значительную дозу йода содержат молочные продукты (сыр рокфор, сыр эдам и сыр бри).
Людям, которые хотят добавить йод в свой рацион, также следует употреблять злаки, в том числе пшеничные отруби, овсяные хлопья, ржаные хлопья. Продуктами с высоким содержанием йода являются дрожжи, водоросли и вода из районов, богатых этим элементом. Овощи с наибольшим содержанием йода включают брокколи и шпинат.
Биологическая роль
Йод относится к микроэлементам и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах. Некоторые морские водоросли (морская капуста, ламинария, фукус и другие) накапливают до 1 % йода. Богаты йодом водные растения семейства рясковых. Йод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
Йод и щитовидная железа
У животных и человека йод входит в состав так называемых тиреоидных гормонов, вырабатываемых щитовидной железой — тироксина и трийодтиронина, оказывающих многостороннее воздействие на рост, развитие и обмен веществ организма.
В организме человека (масса тела 70 кг) содержится 12—20 мг йода. Суточная потребность человека в йоде определяется возрастом, физиологическим состоянием и массой тела. Для человека среднего возраста нормальной комплекции (нормостеник) суточная доза йода составляет 0,15 мг.
Отсутствие или недостаток йода в рационе (что типично для некоторых местностей) приводит к заболеваниям (эндемический зоб, кретинизм, гипотиреоз). В связи с этим к поваренной соли, поступающей в продажу в местностях с естественным геохимическим дефицитом йода, с профилактической целью добавляют йодид калия, йодид натрия или йодат калия (йодированная соль).
Недостаток йода приводит к заболеваниям щитовидной железы (например, к базедовой болезни, кретинизму). Также при небольшом недостатке йода отмечается усталость, головная боль, подавленное настроение, природная лень, нервозность и раздражительность; слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Избыток йода в пище обычно легко переносится организмом, однако в отдельных случаях в людях с повышенной чувствительностью этот избыток может также привести к расстройствам щитовидной железы.
Токсичность

Йод токсичен. Смертельная доза (LD50) — 3 г. Вызывает поражение почек и сердечно-сосудистой системы. При вдыхании паров йода появляется головная боль, кашель, насморк, может быть отёк лёгких. При попадании на слизистую оболочку глаз появляется слезотечение, боль в глазах и покраснение. При попадании внутрь появляется общая слабость, головная боль, повышение температуры, рвота, понос, бурый налёт на языке, боли в сердце и учащение пульса. Через день появляется кровь в моче. Через 2 дня появляются почечная недостаточность и миокардит. Без лечения наступает летальный исход.
ПДК йода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
Радиоактивный йод-131 (радиойод), являющийся бета- и гамма-излучателем, особенно опасен для организма человека, так как радиоактивные изотопы биохимически не отличаются от стабильных. Поэтому почти весь радиоактивный йод, как и обычный, концентрируется в щитовидной железе, что приводит к её облучению и дисфункции. Основным источником загрязнения атмосферы радиоактивным йодом являются атомные станции и фармакологическое производство. В то же время это свойство радиойода позволяет использовать его для борьбы с опухолями щитовидной железы и диагностики её заболеваний (см. выше).
Химические свойства
Йод относится к группе галогенов.
Электронная формула (Электронная конфигурация) йода: 1s22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
Hg + I2 → HgI2
С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
H2 + I2 → 2HI
Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I−:
I2 + H2S → S + 2HI I2 + 2Na2S2O3 → 2NaI + Na2S4O6 Последняя реакция также используется в аналитической химии для определения йода.
При растворении в воде йод частично реагирует с ней (По «Началам Химии» Кузьменко: реакция не идёт даже при нагревании, текст нуждается в проверке)
I2 + H2O → HI + HIO , pK c=15,99
Реакция образования нитрида трийода:
3I2 + 5NH3 → 3NH4I + NH3 ⋅ NI3↓ Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров йода, что демонстрируется как эффектная химическая реакция.
Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
KI + I2 → KI3
Важность формы
Потери йода происходят и в процессе усвоения его организмом. Исследования сотрудников центра пищевых систем им. В.М. Горбатова РАН показали, что усвояемость йода во многом зависит от формы, в которой его принимать.
Ученые провели эксперимент на 80 крысах, поделив грызунов на четыре группы. В первой части эксперимента было выяснено, как добавки йода в разном виде влияют на здоровье животных. В одной из групп крысы получали обычную пищу, а в трех других — различные обогащенные йодом продукты: йодированный молочный белок казеин, йодированные сывороточные белки и соль с йодатом калия.
Поведение животных, аппетит, а также их внешний вид не изменились. Однако уровень гормонов Т3 и Т4 (гормоны щитовидной железы, синтез которых происходит при участии йода) у питавшихся йодированными белками животных стал выше, чем у контрольной группы. У крыс, потреблявших кулинарные изделия с йодированной солью, уровень гормона Т3 был на 17% ниже, чем у крыс, питающихся обычной пищей. При этом уровень Т4 также превосходил контроль, но был ниже, чем у животных, получавших йодированные белки.
— Это важные регуляторы обменных процессов, — пояснил руководитель отдела функционального и специализированного питания центра им. В.М. Горбатова РАН Андрей Дыдыкин. — В случае дефицита Т3 и Т4 происходит повышение образования тиреотропного гормона (вырабатывается в передней доле гипофиза, управляет функцией щитовидной железы), что может вызывать дисбаланс в организме и обменных процессах.
йод

Добыча соли на соленом озере
Фото: ИЗВЕСТИЯ/Павел Кассин
На втором этапе эксперимента у опытных животных искусственным образом создали йододефицит. Для этого подопытным ежедневно внутрижелудочно вводили мерказолил в дозе 50 мг на 1 кг массы тела в течение 25 суток.
В результате этого у всех животных начался гипотериоз (клинический синдром, развивающийся из-за длительной, стойкой недостаточности гормонов щитовидной железы. — «Известия»), характеризующийся снижением двигательной активности, увеличением зоба, снижением аппетита. После чего животные, кроме одной группы, как и в первой части эксперимента, стали получать йод из различных добавок. Их показатели сравнивали с измерениями уровня гормонов у здоровых крыс.
Спустя несколько недель результаты измерения гормонов были следующие. Лучший эффект коррекции йодной недостаточности был достигнут при использовании продуктов, обогащенных йодсодержащими сывороточными белками — уровень Т4 восстановился на 98,7% по сравнению с показателями контрольной группы, Т3 — на 100%. Аналогичные тенденции были отмечены и в группе животных, получавших продукты с йодированным молочным белком казеином. У животных, получавших продукты с йодированной солью, концентрация гормонов Т3 и Т4 была в 1,4 и 1,2 раза ниже контрольной группы.
Согласно выводам ученых, органически связанный йод (содержащийся в белках) усваивается организмом намного лучше.
Таким образом, целесообразность и эффективность законопроекта о йодировании пищевой соли вызывает сомнения. Авторы исследования считают, что он не поможет устранить проблему с дефицитом этого элемента.
По мнению ученых, для обогащения пищевых продуктов йодом необходимо, во-первых, учитывать возраст, пол, регион проживания и профессиональную деятельность граждан. Во-вторых, методы восполнения дефицита этого элемента должны быть проведены с учетом его усвояемости и технических особенностей приготовления еды. И, в-третьих, потребитель имеет право знать сколько йода он получит с каждым продуктом. Поэтому информация о содержании этого элемента должна быть вынесена на этикетку.
Химические свойства галогенов
Галогены (Hal) – мощные окислители, а фтор агрессивен настолько, что вступает в реакцию с собратьями. Происходит это при подогреве. Степень окисления «пострадавших» оказывается +1.
Общее уравнение:
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
Остальные элементы ряда не взаимодействуют с:
-
O;
-
N;
-
С (в модификации алмаза);
-
Pt, Au;
-
Xe, Kr.
С неметаллами
Водород окисляет фтор при любых условиях, со взрывом. Cl с подсветкой УФ или подогревом. Но тоже громко. Остальные только с нагреванием. Но уравнение едино:
С фосфором взаимодействуют совершенно по-разному:
∗ F до получения пентафторида. Единственный, без нагревания:
∗ хлор и бром, в зависимости от концентрации:
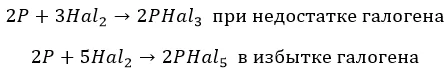
∗ йод – недостаточно мощный окислитель:
∗ с серой также не все очевидно. Но только не с фтором. Окисление максимально, но с нагревом:
∗ бром и хлор реагируют нетипично и «неохотно»:
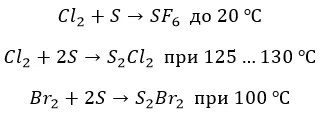
С металлами
Перед фтором ничто не устоит. Даже благородный класс, хоть и с нагревом:
Остальные металлы прочим галогенам по силам. Не без подогрева:
Реакции замещения
Агрессивные вытесняют «тяжелых» соседей по группе:
И с неметаллами не церемонятся:
Хлор, как более активный, ведет себя несколько по-другому:
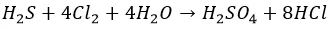
С водой
Фтор в своем репертуаре. Вода будет пылать синим пламенем и норовить плюнуть плавиковой кислотой:
Хлор с бромом гораздо спокойнее. Да и процессы нестабильны, обратимы:
Йод с водой в видимые взаимодействия не вступает.
С растворами щелочей
И в этом случае фтор проявляется как резкий окислитель:
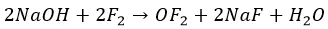
Остальные ведут себя, как с водой. Но процесс при разных температурах проходит по разным сценариям:
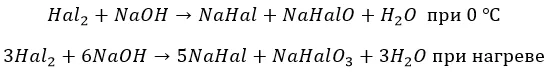
Йод реагирует только по второму варианту.
Физические свойства
Из всех микроэлементов йод считается самым противоречивым. Большинство людей не знают о его особенностях. Физические и химические свойства йода кратко изучаются в школе. В основном распространен этот элемент в виде изотопа с массой 127. Это самый тяжелый из всех галогенов. Есть еще радиоактивный йод 125, который получается при распаде урана. В медицине же чаще применяются искусственные изотопы этого элемента с массой 131 и 133.
Из всех галогенов йод единственный, который в естественном состоянии твердый. Он может быть представлен темно-фиолетовыми или черными кристаллами или пластинками с металлическим блеском. Они имеют слабый характерный запах, хорошо проводят электрический ток и немного похожи на графит. В таком состоянии этот микроэлемент плохо растворяется в воде, но очень легко переходит в газообразное состояние. Он может превратиться в фиолетовый пар уже при комнатной температуре. Эти физико-химические свойства йода используются для его получения. Нагревая микроэлемент под давлением, а потом охлаждая, его очищают от примесей. Растворяют йод в спирте, глицерине, бензоле, хлороформе или сероуглеродах, получая бурые или фиолетовые жидкости.
Применение галогенов
Фтор или правильнее будет назвать фторид меди (CuF2) имеет довольно таки широкое применение. Его используют при изготовлении керамики, эмалей и различных глазурей.
Имеющая в каждом доме тефлоновая сковородка и хладагент в холодильниках и кондиционере, также появились благодаря фтору.
Кроме бытовых нужд тефлон также используют в медицинских целях, так как его применяют при производстве имплантатов. Фтор необходим при изготовлении лизн в оптике и в зубных пастах.
Хлор также в нашей жизни встречается буквально на каждом шагу. Самым массовым и распространенным применением хлора, является, конечно же, поваренная соль NaCl. Она так же выступает в роли дезинтоксикационного средства и используется в борьбе с гололедом.
Кроме этого, хлор незаменим в производстве пластика, синтетического каучука и поливинилхлорида, благодаря которым мы получаем одежду, обувь и другие, нужные в нашей повседневной жизни вещи. Его используют при производстве отбеливателей, порошков, красителей, а также другой бытовой химии.
Бром, как правило, необходим, как светочувствительное вещество при печатании фотографий. В медицине он применяется, как успокаивающее средство. Также бром используют при производстве инсектицидов и пестицидов и т.д.
Ну, а всем известный йод, который имеется в аптечке у каждого человека, в первую очередь используется, как антисептик. Кроме своих антисептических свойств, йод присутствует в источниках света, а также является помощником для обнаружения отпечатков пальцев на бумажной поверхности.
Йод в организме человека
Полезные свойства йода имеют особое значение для всего человеческого организма, так как применение данного вещества в медицинской практике давно уже себя оправдало.
Как утверждают многие источники, элемент особо необходим щитовидной железе, поскольку является незаменимой составляющей ее гормонального фона.
Именно в этой части тела концентрация химического элемента составляет больше 65%, остальные 35% сосредоточены в мышечных тканях, крови, яичниках. В микрограммах это не менее 50 в сутки для детского организма, 120-150 – для взрослого, 190-210 – для беременных и кормящих женщин.
При этом влияние данного вещества на все жизненные процессы действительно неоценимо:
- йод контролирует теплорегуляцию тела;
- способствует обмену веществ, метаболизму, водно-электролитным процессам;
- отвечает за правильное развитие мышечной ткани, опорно-двигательного аппарата.
ВАЖНО! Не стоит забывать и о психологическом/эмоциональном здоровье, стабильность которого во многом зависит от концентрации микроэлемента. НО! Органы и ткани не могут самостоятельно вырабатывать галоген, поэтому для их полноценного функционирования столь важны внешние источники элемента: продукты питания, морской воздух, лекарственные препараты
Признаки нехватки йода
Настолько ли важен для человеческой жизни обычный йод? И чем грозит его дефицит?
- Постоянное чувство усталости. А еще вялость, сонливость, апатия. Именно так проявляется значительное снижение гормонов щитовидной железы, которые отвечают за жизненную энергию организма.
- Железодефицитная анемия. Сопровождает йододефицит уже на довольно запущенной стадии (бледность кожных покровов, слабость, приступы головокружения).
- Повышенная отечность. Особенно на уровне глаз. Употребление мочегонных средств для устранения такой патологии абсолютно бесполезно.
- Ослабление иммунной системы. Проявляется как неспособность защитных сил блокировать инфекционные заболевания вирусного/паразитарного типа, недуги простудного характера, грибковые заболевания.
- Лишний вес. Человек с недостатком йода испытывает хронический голод. Кроме того нарушается обмен веществ, тело пациента постепенно отекает.
- Низкое артериальное давление. Гипотония тесно связана с недостаточной деятельностью щитовидной железы, сопровождается аритмией, головными болями, одышкой.
- Снижение умственных способностей. В первую очередь страдает память, способность к рациональному мышлению, творческое начало.
- Психологическая подавленность. Депрессивное состояние, эмоциональная нестабильность, апатия.
Признаки избытка йода
Как показывает практика, все должно быть равномерно. Ведь вред йода – не выдуманный факт, поскольку данный элемент в избыточном количестве более чем опасен для организма. Имеется в виду отравление галогеном, хроническое или острое. В первом случае организм стабильно получает значительную дозу химического вещества, но для яркой клинической картины этого не достаточно. Поэтому первые признаки могут появиться спустя годы.
Острая форма отравления заявляет о себе немедленно, провоцируя нарушение работы сердечно-сосудистой/дыхательной систем. Жизни пациента угрожает опасность, а здоровью – инвалидность.
Однако не каждый переизбыток йода можно назвать отравлением. Чаще всего патология проявляется как комплекс симптомов:
- Йододерма или поражение кожных покровов
- У больного (область лица, шеи, рук, ног) появляется характерная сыпь, чем-то напоминающая угревую. Отличительным фактором считается сильный дискомфорт, жжение, зуд, а также своеобразное слияние нескольких образований в одно пятно с багровым оттенком.
- Конъюктивит. Слизистые оболочки особенно уязвимы перед галогеном, что проявляется как воспалительные процессы, слезотечения, ухудшения зрения.
- Респираторные заболевания. Спровоцированы раздражением слизистой дыхательных путей.
- Повышенное слюноотделение. Слюнные железы также страдают от повышенной концентрации йода в организме, отекают/воспаляются.
- Дополнительная симптоматика Встречается реже, но, все же, имеет место: металлический привкус во рту, неприятный запах, дискомфорт слизистой горла, сбой работы ЖКТ/мочеполовой системы, снижение иммунитета, сильная слабость, безвольность, токсический гепатит. Часто об избытке йода говорит Базедова болезнь.
Информация о йоде
Йод — это минеральное вещество. Минеральные вещества являются видом питательных веществ, необходимых для надлежащей работы организма. Организм использует йод для выработки определенных гормонов (например, гормонов щитовидной железы), которые помогают регулировать работу других органов.
Весь имеющийся в организме йод поступает из рациона питания. Большую часть йода в рационе питания дает йодированная соль и другие продукты, содержащие добавленный йод. Лишь некоторые продукты питания (например, морские водоросли, молочные продукты и некоторые виды рыбы) содержат йод от природы.
Применение
Йодоводород используют в лабораториях как восстановитель во многих органических синтезах, а также для приготовления различных йодсодержащих соединений.
Спирты, галогениды и кислоты восстанавливаются HI, давая алканы.
-
- C4H9Cl + 2 HI → C4H10 + HCl + I2
При действии HI на пентозы он все их превращает во вторичный йодистый амил: CH3CH22CH2CHICH3, а гексозы — во вторичный йодистый н-гексил.
Легче всего восстанавливаются йодпроизводные, некоторые хлорпроизводные не восстанавливаются вовсе. Третичные спирты восстанавливаются легче всего. Многоатомные спирты также реагируют в мягких условиях, часто давая вторичные йодалкилы.
HI при нагреве диссоциирует на водород и I2, что позволяет получать водород с низкими энергетическими затратами.






