Источники поступления
ДО 60% йода поступает к нам в составе животных продуктов, до 30% — растительных, а остальное – с водой. Некоторое количество микроэлемента мы получаем в составе вдыхаемого воздуха. Общепризнанные лидеры по содержанию I – рыба и морепродукты.
Содержание I в 100 г продуктов:
| Продукт | Содержание, мг/100 г |
| Сушеная ламинария (морская капуста) | 2500-3000 |
| Приготовленная морская капуста | 300 |
| Кальмары | 290 |
| Креветки, крабы, устрицы | 90-100 |
| Мясо ластоногих | 130 |
| Треска, путассу | 130 |
| Лосось | 200 |
| Минтай, хек | 150-160 |
| Окунь, судак, сом, щука, камбала, судак, мойва | 50 |
| Анчоусы, скумбрия | 45 |
| Мидии | 190 |
| Шампиньоны | 18 |
| Яичный желток | 35 |
| Молоко и кисломолочные продукты | 8-18 |
| Бобовые, овощи, свежая зелень | 6-15 |
| Ягоды, фрукты, злаки | 2-10 |
| Кедровые орехи | 400 |
| Твердые сорта сыра | 11 |
При термической обработке продукты теряют до 50% и более находящегося в них йода. Чтобы свести потери микроэлемента к минимуму, продукты следует варить целыми или нарезанными крупными кусками на слабом огне, в небольшом объеме воды, непродолжительное время, и в посуде, накрытой крышкой.
Еще один искусственный пищевой источник йода – йодированная соль. Это поваренная соль, натрия хлорид, с добавлением йодистых соединений – иодидов и иодатов натрия и калия. Употребление йодированной соли рекомендовано лицам, проживающим в эндемичных йододефицитных районах.
При этом следует учитывать некоторые факты. Йодированная соль придает продуктам специфический горьковатый привкус, и при нагревании количество йода снижается. По этим причинам ее не стоит использовать при кипячении, варке, и консервировании продуктов. Добавляют ее в пищу непосредственно перед употреблением. Срок годности такой соли в сравнении с обычной, без йода, небольшой, и составляет 6 мес. Хранить ее следует в защищенном от света месте.
Сублимация и растворимость
Уменьшение взаимного притягивания атомов йода в его молекуле приводит, как мы говорили ранее, к ослаблению прочности ковалентной неполярной связи. Происходит снижение устойчивости соединения к высокой температуре и повышение показателя термической диссоциации его молекул. Отличительная черта галогена: переход вещества при нагревании из твердого состояния сразу в газообразное, т. е. сублимация — это главная физическая характеристика йода. Его растворимость в органических растворителях, например сероуглероде, бензоле, этаноле, выше, чем в воде. Так, в 100 г воды при 20 °С может раствориться всего 0,02 г вещества. Эту особенность в лаборатории применяют для извлечения йода из водного раствора. Взболтав его с небольшим количеством H2S, можно наблюдать фиолетовое окрашивание сероводорода вследствие перехода в него молекул галогена.
Применение йода:
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
- https://en.wikipedia.org/wiki/Iodine
- https://de.wikipedia.org/wiki/Iod
- https://ru.wikipedia.org/wiki/Иод
- http://chemister.ru/Database/properties.php?dbid=1&id=263
- https://chemicalstudy.ru/yod-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: Фото https://www.pexels.com, https://pixabay.com
Найти что-нибудь еще?
карта сайта
йод атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решеткаатом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома электронные формулы сколько атомов в молекуле йода йодсколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
2 526
История открытия
Впервые иод был получен в 1811 г. французом Куртуа. Это был химик, а заодно – владелец селитроварни. Соду для изготовления селитры он получал из золы морских водорослей. Когда Куртуа добавил к рассолу от золы концентрированную серную кислоту, началась реакция с выделением фиолетовых паров, запахом напоминающих хлор.
Это были пары иода. Правда, молва приписывает открытие не самому Куртуа, а его коту. Якобы животное случайно опрокинуло сосуд с кислотой на зольный рассол.
В 1813-14 г. французский и английский химики, Гей-Люссак и Дэви, идентифицировали новый элемент, и назвали его иодом от греческого «иоэйдес», фиолетовый. Буквально сразу же после открытия, в 20-х г. XIX в., были изучены полезные свойства йода как лекарственного средства в лечении заболеваний щитовидной железы.
Примечательно, что вплоть до середины прошлого века вещество называли йодом, и в таблице Менделеева обозначали буквой J, Jodum. Затем элемент решили обозначать как иод, а букву J заменили на I.
Однако и в русском языке, и в некоторых европейских языках наряду с общепринятым термином продолжают использовать старый. Название «йод» употребляют в разговорной речи, а также для обозначения медицинских препаратов, биологических процессов.
Нахождение в природе
Йод в природе достаточно рассеян, благодаря чему содержится почти во всех телах планеты. Но в чистом виде обнаружить его практически нереально. Небольшие залежи имеются в Чили, Японии, но, в большинстве случаев, вещество приходится добывать из водорослей, селитры, вод нефтяного происхождения.
Значительная концентрация элемента – в морской воде, черноземе, торфе. Основным же «резервуаром» галогена считается Мировой океан, из которого галоген попадает в атмосферу, на континенты. Территория, отдаленная от океана, справедливо считается бедной на это вещество. То же самое касается горной местности.

Недостаток, нехватка, дефицит йода и избыток в организме: признаки у женщин и мужчин
Возможно, вы и не догадываетесь о нехватки йода в своем организме. Точнее, некоторые симптомы не вызывают особого беспокойства. Ведь пока проблема не становиться явной, о ее начальной стадии не часто задумываешься. Хотя, в случае недостатка йода первое, что должно насторожить, это:
ухудшение памяти и общее плохое усваивание информации;
общая апатия и потеря какого-либо интереса к происходящему;
сонливость и быстрая утомляемость;
рассеянное внимание, забывчивость и не способность сфокусироваться на какой-то поставленной задаче или работе. Но не стоит путать с невнимательностью;
ломкие ногти и обильное выпадение волос (хотя, часто причина может скрываться и в других недугах);
может проявляться в виде ухудшения слуха или голос становится сиплым.
излишняя потливость, а также отдышка – это еще одни первые признаки недостатка йода.. Признаки недостатка йода
Признаки недостатка йода
Явными признаками дефицита йода служат:
Отечность лица и нижних конечностей. Связанно это с тем, что лишняя жидкость не выводиться из организма.
В целом, ухудшается внешний вид. Появляются морщинки, кожа становиться вялой и несвежей. А также, проявляются признаки раннего старения.
Это все сопровождается болью в мышцах и суставах, которые не поддаются медикаментозному устранению.
В целом, падает иммунитет, человек начинает часто болеть вирусными и простудными заболеваниями.
А еще, одним из симптомов может быть тошнота или рвота, а также не усваивание продуктов.
Ну и, конечно, увеличение щитовидной железы, которое в медицине называют эндемическим зобом
Но такой симптом может опознать лишь врач.
Важно! У кормящих мам может начать кровоточить соски, а количество молока может значительно уменьшиться.
Кстати, можно дома провести такой быстрый и очень простой тест. Для его проведения требуется лишь один компонент:
- йод
- ватная палочка
Недостаток йода: симптомы
Делаем йодную сетку. Желательно, рисовать ее внутренней стороне бедра или предплечье.
- Ели сетка сохранилась более 6 часов на вашем теле, значит с содержанием йода все в порядке
- Если же ее устойчивость продержалась менее 6 часов, но более трех, тогда есть небольшая нехватка йода
- Если же такая сетка исчезла менее чем через 3 часа, тогда стоит обратиться к эндокринологу
Также такой тест можно сделать немного другим образом. Нанесите три полоски на предплечье или внутреннюю сторону бедра. Делать такую процедуру нужно непосредственно перед сном.
- Если на утро исчезла только одно полоска, значит все в порядке
- Если две, соответственно, есть небольшая нехватка
- Если же все три, тогда существует критическая потребность в йоде
Список продуктов
Йод (ниже представлен список, в каких продуктах он содержится) поступает в человеческое тело только с пищей и водой, поэтому тем, кто испытывает нехватку данного элемента, нужно знать, в какой именно пище его концентрация выше всего.
Растительного происхождения
Больше всего данного элемента в представителях растительного царства, особенно в морских водорослях. Растения впитывают йод из минералов, растворённых в воде, и аккумулируют его.
- Морская капуста (ламинария). Достаточно 100г этого продукта, чтобы полностью закрыть дневную норму микроэлемента. Морская капуста в маринованном виде – тяжёлый, недиетический продукт, поэтому желательно сделать из неё запеканку или есть небольшими количествами;
- Хурма более богата йодистыми соединениями, чем другие наземные растения (конкурировать с ней в содержании этого элемента способны только водоросли). Кроме того, в хурме содержатся и другие микроэлементы: магний, натрий, железо, а так же витамины;
- Гречневая каша;
- Семечки яблок. В некоторых семечках элемента так много, что можно почувствовать его привкус. Чтобы поддерживать концентрацию этого галогена в организме в норме, человеку достаточно съедать 5 семечек в день. Однако, при злоупотреблении могут развиться симптомы избытка йода. С другой стороны, яблочные семечки содержат те же вещества, что и косточки слив, и подвергаясь разложению, выделяют синильную кислоту. Поэтому поедание большого количества косточек чревато ещё и серьёзным отравлением. Употреблять следует косточки зрелых яблок;
- Фейхоа является ценным с точки зрения микроэлементов растением. Полезно употребление как мякоти, так и кожуры;
- Достаточно богаты этим элементом шпинат и щавель. Эти растения содержат так же много витаминов С и К и часто используются для приготовления салатов в западных странах, где давно сформировалась привычка вести здоровый образ жизни. Некоторые источники указывают, что шпинат является рекордсменом по количеству йода среди наземных растений (другие приписывают 1-е место хурме);
- Бананы. Сладкие фрукты содержат в среднем по 3 мкг этого микроэлемента. При этом они хорошо усваиваются и практически безвредны для любого желудка;
- Кукуруза. Съешьте 100 граммов кукурузы в виде консервов на ужин, и дневная норма выполнена;
- Зелёная фасоль. Этот источник подойдёт не любому желудку. Но если Вы можете есть этот продукт, то полкружки в день достаточно. Содержит так же много витаминов.
Животного происхождения
Животные получают сей микроэлемент в основном из растений, а затем накапливают его в определённых органах и тканях. Больше всего йода в печени, жировой ткани, яйцах или икре. Среди различных видов животных этим элементом богаче организмы морских обитателей и птиц, питающихся зёрнами.
В каких продуктах содержится йод больше всего:
- Красной икре. В этом продукте йод содержится в наиболее легкоусвояемой форме, поскольку усваиванию способствуют витамины и микроэлементы, содержащиеся в том же продукте. Кроме того, красная икра быстро переваривается и подходит для людей с больным желудком;
- Печень трески. Этот деликатесный продукт очень питателен и содержит, помимо йода, много других полезных веществ, которые помогают скорейшему усваиванию. Количество йода в печени – 350 мкг в 100 граммах;
- Креветки. Достаточно съесть 4 порции, чтобы полностью покрыть дневную норму. Мясо креветок легко усваивается, а поэтому йод быстро всосётся в кровь. Кроме того, мясо питательно и содержит много белка;
- Мясо тунца, особенно консервированное;
- Вареные яйца. Можно использовать яйца любых птиц: куриные, гусиные, перепелиные, голубиные;
Другое: В каких продуктах питания есть много йода: прекрасным источником галогена является йодированная соль и приправы на её основе, а так же приправы, содержащие в своём составе бурые водоросли. Вода может содержать йод в больших количествах (особенно некоторые сорта йодобромистых минеральных вод), а может и вовсе его не иметь. Это зависит от конкретного источника.
Свойства йода (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Йод |
| 102 | Прежнее название | |
| 103 | Латинское название | Iodum |
| 104 | Английское название | Iodine |
| 105 | Символ | I |
| 106 | Атомный номер (номер в таблице) | 53 |
| 107 | Тип | Неметалл |
| 108 | Группа | Галоген |
| 109 | Открыт | Бернар Куртуа, Франция, 1811 г. |
| 110 | Год открытия | 1811 г. |
| 111 | Внешний вид и пр. | Кристаллы чёрно-серого цвета с фиолетовым металлическим блеском. Легко образует фиолетовые пары, обладающие резким запахом |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,000049 % |
| 120 | Содержание в морях и океанах (по массе) | 6,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | 0,000025 % |
| 124 | Содержание в организме человека (по массе) | 0,00002 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 126,90447(3) а. е. м. (г/моль) |
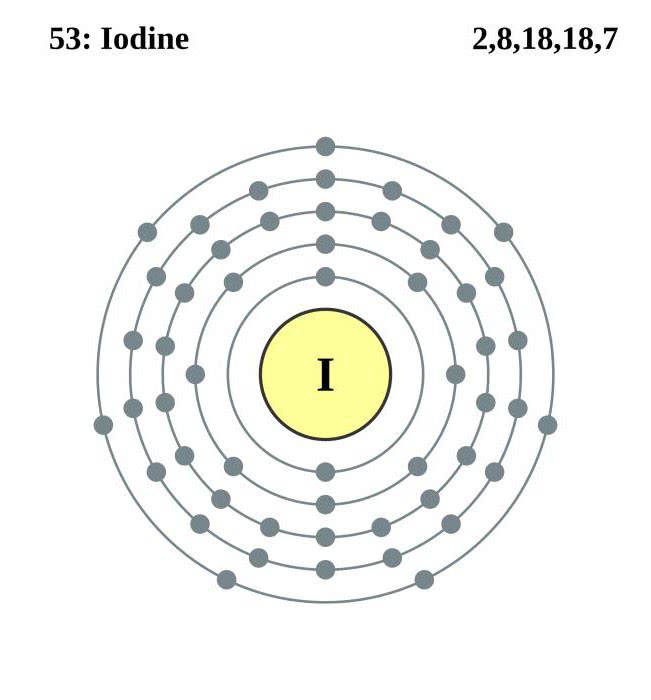
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5 |
| 203 | Электронная оболочка |
K2 L8 M18 N18 O7 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 115 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 139 пм |
| 207 | Радиус иона (кристаллический) | I–
206 (6) пм, I 5+ 109 (6) пм, I 7+ 67 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 198 пм |
| 209 | Электроны, Протоны, Нейтроны | 53 электрона, 53 протона, 74 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 17-ая группа (по старой классификации – главная подгруппа 7-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0, +1, +3, +4, +5, +6, +7 |
| 302 | Валентность | I, III, V, VII |
| 303 | Электроотрицательность | 2,66 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1008,39 кДж/моль (10,451260(25) эВ) |
| 305 | Электродный потенциал | I2 + 2e– → 2I–, Eo = +0,536,
I3– + 2e– → 3I–, Eo = +0,545 |
| 306 | Энергия сродства атома к электрону | 295,2 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 4,933 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело)
4,866 г/см3 (при 60 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | 113,7 °C (386,85 K, 236,66 °F) |
| 403 | Температура кипения* | 184,3 °C (457,4 K, 363,7 °F) |
| 404 | Температура сублимации* | При нагревании при атмосферном давлении |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 15,52 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 41,57 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 54,44 Дж/(K·моль) |
| 411 | Молярный объём | 25,7 см³/моль |
| 412 | Теплопроводность | 0,449 Вт/(м·К) (при стандартных условиях),
0,45 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки |
Орторомбическая |
| 513 | Параметры решётки | a = 7,18 Å, b = 4,71 Å, c = 9,81 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Cmca |
| 517 | Номер пространственной группы симметрии | 64 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7553-56-2 |
Примечание:
205* Эмпирический радиус атома йода согласно составляет 136 пм.
206* Ковалентный радиус йода согласно и составляет 139±3 пм и 133 пм соответственно.
401* Плотность йода согласно и составляет 4,93 г/см3 (при 25 °C и иных стандартных условиях, состояние вещества – твердое тело) и 4,94 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления йода согласно и составляет 113,5 °С (386,65 K, 236,3 °F) и 114 °С (387,15 K, 237,2 °F) соответственно. Жидкий йод согласно можно получить, нагревая его под давлением.
403* Температура кипения йода согласно и составляет 184,35 °C (457,5 K, 363,83 °F) и 185,5 °С (458,65 K, 365,9 °F) соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) йода согласно составляет 41,95 кДж/моль.
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:

- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Химические свойства[править | править код]
Иод относится к группе галогенов.
Электронная формула (Электронная конфигурация) иода: 1s22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO2), иодноватую (HIO3), иодную (HIO4).
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на иод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами иод при лёгком нагревании энергично взаимодействует, образуя иодиды:
-
- Hg+I2→HgI2{\displaystyle {\mathsf {Hg+I_{2}\rightarrow HgI_{2}}}}
С водородом иод реагирует только при нагревании и не полностью, образуя иодоводород:
-
- H2+I2{\displaystyle {\mathsf {H_{2}+I_{2}}}} ⇄ 2HI↑{\displaystyle {\mathsf {2HI}}\uparrow }
Иод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I−:
-
- I2+H2S→S+2HI↑{\displaystyle {\mathsf {I_{2}+H_{2}S\rightarrow S+2HI}}\uparrow }
-
- I2+2Na2S2O3→2NaI+Na2S4O6{\displaystyle {\mathsf {I_{2}+2Na_{2}S_{2}O_{3}\rightarrow 2NaI+Na_{2}S_{4}O_{6}}}}
Последняя реакция также используется в аналитической химии для определения иода.
При растворении в воде иод частично реагирует с ней
-
- I2+H2O→HI+HIO,{\displaystyle {\mathsf {I_{2}+H_{2}O\rightarrow HI+HIO}},} pKc=15,99
Реакция образования аддукта нитрида трииода с аммиаком:
-
- 3I2+5NH3→3NH4I+NH3⋅NI3↓{\displaystyle {\mathsf {3I_{2}+5NH_{3}\rightarrow 3NH_{4}I+NH_{3}\cdot NI_{3}\downarrow }}}
Это вещество почти не имеет практического значения и известно лишь своей способностью разлагаться со взрывом от малейшего прикосновения.
Иодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полииодидов (периодидов) — трииодид калия, дихлороиодат(I) калия:
-
- KI+I2→KI3{\displaystyle {\mathsf {KI+I_{2}\rightarrow KI_{3}}}}
- Реакции с простыми веществами:
- I2+3F2→CCl3F−452IF3{\displaystyle {\ce {I2 + 3F2 -> 2IF3}}}
Применение йода в жизни
Учитывая целебные свойства микроэлемента, основная его роль приходится на поддержание полноценного функционирования человеческого организма, а также устранение тех или иных заболеваний:
- Всего несколько капель йода на стакан воды (особенно с содой, солью) помогут быстро избавиться от ангины или других гнойных процессов на слизистой горла.
- Йодная сетка отлично обезболивает, рассасывает тромбы, снимает воспаление, отечность. Достаточно лишь нарисовать ее с помощью ватной палочки и аптечного раствора йода, поновляя раз в несколько дней. Исключение становят маленькие дети, на нежную кожу которых вещество может повлиять довольно агрессивно.
- Не менее популярен раствор Люголя, которым смазывают горло при ангине/повышенной болезненности/ангулярном стоматите.
- С помощью раствора йода легко дезинфицировать повреждения кожных покровов.
ИНТЕРЕСНО! Однако не только медицина оценила полезные свойства йода. Благодаря этому веществу криминалисты снимают отпечатки пальцев, промышленные отрасли продолжают производство аккумуляторов, а также появляются дополнительные источники света.
Особенности электронной формулы
Пять энергетических уровней и почти полностью заполненный электронами последний из них подтверждают наличие у элемента ярко выраженных признаков неметаллов. Как и другие галогены, йод является сильным окислителем, забирая у металлов и более слабых неметаллических элементов — серы, углерода, азота — недостающий до завершения пятого уровня электрон.
Йод – неметалл, в молекулах которого присутствует общая пара p-электронов, связывающая атомы между собой. Их плотность в месте перекрывания наибольшая, общее электронное облако не смещается ни к одному из атомов и располагается в центре молекулы. Формируется неполярная ковалентная связь, а сама молекула имеет линейную форму. В ряду галогенов, от фтора до астата, прочность ковалентной связи уменьшается. Наблюдается уменьшение величины энтальпии, от которой зависит распад молекул элемента на атомы. Какие же последствия для химических свойств йода это имеет?
Йодосодержащие продукты
Основное поступление такого необходимого для организма галогена происходит из продуктов питания. Сейчас про пользу йода для человека много говорят и по телевизору, и пишут в статьях. Рассмотрим и мы с вами, откуда можно получить такой необходимый нам элемент.
- Морепродукты — больше всего содержится йода в ламинарии. Это такая водоросль. Салат с морской капустой не только вкусный, но и полезный. При выборе, что купить — речную или морскую рыбу, отдайте предпочтение последней. Употребляйте в пищу устрицы и креветки, мидии и кальмары, а также рыбий жир.
- Овощи — полезны все корнеплоды: морковка и редька, картошка и репчатый лук, чеснок и свекла. Много йода в зеленых продуктах — спарже и шпинате, ревене и салате, капусте, а также в помидорах.
- Ягоды — большое количество такого необходимого йода есть в черной смородине, клубнике, а также в темном винограде и черноплодной рябине, землянике.
- Полезны куриные яйца, особенно желток.
- Фрукты — хурма, бананы и фэйхоа, а также наши яблоки, сливы, абрикосы и вишня.
- Полезны орехи, как грецкие, так и кедровые.
- Крупы — гречка и пшено.
- Высоко содержание йода в натуральных молочных продуктах, а именно в молоке, твороге и твердом сыре.
Частые вопросы о йоде
Правда ли, что дефицит йода можно определить в домашних условиях с помощью йодной сетки?
Бытует мнение, что при йододефиците нанесенная на кожу йодная сетка должна потускнеть. Но это не так.
Установить, действительно ли организм испытывает дефицит этого микроэлемента, можно только с помощью лабораторного исследования (на содержание йода исследуется моча).
Можно ли восполнить дефицит если выпить каплю йода?
Делать этого ни в коем случае нельзя! И не только потому, что в этой капле содержится йода в 30 раз больше, чем требуется человеку в сутки, но и потому что это просто опасно.
Пострадает наша щитовидная железа.
Недостаток йода как-то ощущается человеком?
Если организм регулярно испытывает нехватку йода, то быстро устает, чувствует себя разбитым и обессиленным, но чаще всего списывает это на банальное недомогание и усталость.
А ведь это первые признаки дефицита йода.
Поможет ли йодированная соль?
Йодированная соль — хороший помощник в деле профилактики йододефицита. Всего 1/3 чайной ложки способны восполнить суточную потребность организма в йоде (в 1 г соли содержится 40 мкг йода).
Но ее нужно использовать правильно. Так как при высоких температурах йод разрушается, то солить пищу стоит в самом конце или даже после приготовления.
Такую соль и хранить нужно правильно. После открытия пачки соли, срок ее хранения не должен превышать 4 месяцев.
Нужно следить за тем, чтобы после каждого использования пачка была плотно закрыта, не пропускала воздух и влагу.
БУДЬТЕ ВНИМАТЕЛЬНЫ К СВОЕМУ ЗДОРОВЬЮ!






