Тяжесть отравления
Зависит от дозы, индивидуальных биологических особенностей (содержание фермента АДГ генетически ниже в организме северных народов), веса человека.
Выделяют:
- Лёгкую степень: без потери сознания. Офтальмопатичекие признаки начинаются с пелены перед глазами, нечёткости зрения, расширения зрачков. Основные проявления желудочные (тошнота, боль в желудке); восстановление происходит через 3—5 суток.
- Средней тяжести (дополнительное название «офтальмическая»): все признаки более выражены. Но потери сознания нет. Ведущий симптом — нарушение зрения, слепота. Лёгкие нормально работают, гемодинамические показатели не ухудшаются.
- Тяжёлая с поражением всех органов и систем (генерализованная). После скрытой фазы быстро развёртываются неврологические симптомы, сильное возбуждение, рвота, боли в икроножных мышцах; влияние на сосудистую систему приводит к сердечной недостаточности (цианоз); нарушается дыхание; возникают судороги. Затем кома. Смерть возможна на фоне острого отёка мозга, острого панкреатита, декомпенсированного токсического шока. Летальный исход может наступить на 1—2 сутки.
Общество и культура
В исследовании, опубликованном в 2002 году, было установлено, что 41% смертей в автомобильных авариях происходит из-за вождения в нетрезвом виде. Чем больше содержание алкоголя в крови водителя, тем больше риск. Употребление спиртных напитков имеет давнюю историю. Этому социальному явлению посвящены множество исследований.
Процесс распития алкогольных напитков и опьянение описаны во множестве художественных произведений. Известный новогодний фильм «Ирония судьбы, или С легким паром!» посвящен как раз последствиям злоупотребления спиртными напитками, пусть и в комедийной форме. Многие творческие люди использовали алкоголь как необходимый элемент генерации новых идей или легкий способ преодоления стресса.
Умеренное употребление алкоголя является приемлемым и даже желательным явлением в большинстве современных культур. Распитие спиртных напитков – это традиция на многих торжественных мероприятиях. Исключение составляет Ислам. По правилам этой религии, употребление любых спиртных напитков – это страшный грех.
Суррогатный алкоголь и его разновидности
Суррогаты не предусмотрены для употребления внутрь, поскольку содержат спирты, которые применяются для бытовых нужд.

Есть две группы алкогольных суррогатов: с этиловым спиртом и без него.
Этиловый спирт содержат следующие вещества:
- денатурат — 82 % спирта;
- политура — 90 % спита;
- бутанол — может содержаться разное количество спирта;
- лосьоны и одеколоны — более 50 % спирта;
- сульфитный и гидролизный спирты — тот же этанол, только более токсичный;
- морилка — может содержать разное количество спирта;
- настойки лекарственных трав — пустырник, боярышник.
Суррогаты без этилового спирта:
- муравьиный спирт;
- пропиловый спирт;
- амиловый спирт;
- метиловый спирт;
- бутиловый спирт;
- этиленгликоль.
Все эти вещества не предназначены для внутреннего употребления, но, к сожалению, алкозависимых людей это не останавливает.
Действие метанола на организм человека

В зависимости от того, какое количество выпито метилового спирта, такое и он окажет действие. При умеренной и лёгкой степени отравления метилом отмечаются следующие первые признаки:
- Спутанность сознания и головокружение;
- Расширение зрачков;
- Боль в голове;
- Тошнота и рвота, спазмы в желудке;
- Сильная одышка;
- Потемнение в глазах, возникновение мельтешения и пятен перед глазами;
- Посинение кожного покрова;
- Потеря контроля над движениями;
- Ощущение боли при надавливании на правый бок;
- Резкий скачок давления и последующее его понижение;
- Общая слабость при усиленных сухожильных рефлексах и ломоты во всех мышцах.
Тяжёлая степень отравления метиловым спиртом характеризуется беспричинной агрессией больного, сильным понижением давления, дезориентацией в пространстве, ухудшением зрения (вплоть до абсолютной слепоты), посинением губ, конечностей, помутнением создания и выраженными судорогами ног и рук.
Где вы обычно покупаете алкогольную продукцию?
- У частных лиц
- В ларьках
- В специализированных магазинах
- Не употребляю алкоголь
Загрузка …
Если вовремя не принять меры и не оказать медпомощь, то у человека могут проявится более тяжёлые симптомы, обозначенными тремя стадиями.
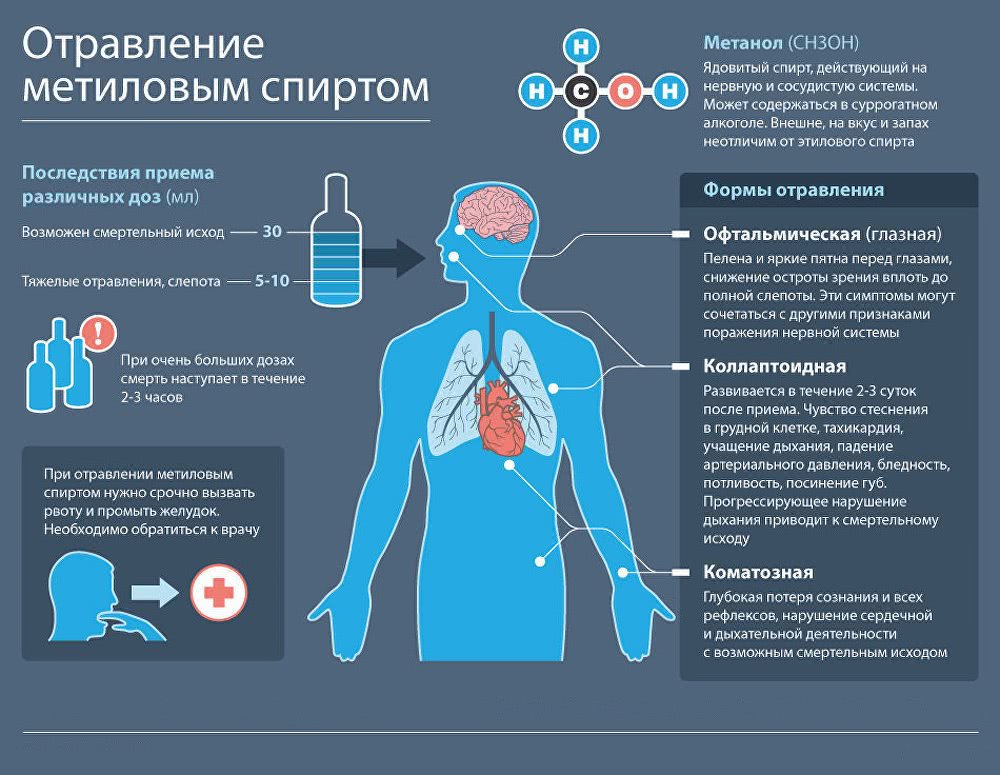
- Офтальмическая (глазная) — отмечается мельтешение пятен и «мурашек» перед глазами, постепенно сливающихся в сплошную плёнку. Затем зрачки перестают реагировать на световой источник, и отравившийся медленно слепнет.
- Коллаптиоидная — на этой стадии ощущается нехватка воздуха, стеснение за грудной клеткой на фоне учащённого пульса и ритма сердца. Давление становится сниженным до критической отметки, возникает синюшность кожи, невыносимая слабость и обильное выделение пота. Дыхание больного прерывистое.
- Коматозная — кожа становится мраморного оттенка, а веки отекают. Происходит полное поражение выделительной системы. Отравившийся пребывает без сознания с отсутствующими рефлексами. Отмечается абсолютный упадок дыхательной и сердечной функции, что способно повлечь за собой смерть.
При неоказании первой помощи при отравлении метилом и отсутствии госпитализации по прошествии 72 часов у больного может наступить летальный исход.
Токсичность
Употребление всего 10 мл чистого метанола может вызвать необратимую слепоту из-за разрушения зрительного нерва . 30 мл (1,0 жидких унций США) потенциально смертельны. Средняя смертельная доза составляет 100 мл (3,4 жидких унций США), то есть 1-2 мл / кг массы тела чистого метанола. Контрольная доза метанола составляет 0,5 мг / кг в сутки. Токсические эффекты начинаются через несколько часов после приема внутрь, и антидоты часто могут предотвратить необратимое повреждение. Из-за его сходства как по внешнему виду, так и по запаху с этанолом (спирт в напитках), их трудно различить; так же обстоит дело с денатурированным спиртом , фальсифицированными ликерами или алкогольными напитками очень низкого качества.
Метанол токсичен по двум причинам. Во-первых, метанол может быть фатальным из-за воздействия на центральную нервную систему, действуя как депрессант центральной нервной системы так же, как . Во-вторых, в процессе отравления он метаболизируется до муравьиной кислоты (которая присутствует в виде формиат-иона) через формальдегид в процессе, инициированном ферментом алкогольдегидрогеназа в печени . Метанол превращается в формальдегид через алкогольдегидрогеназу (ADH), а формальдегид превращается в муравьиную кислоту (формиат) через альдегиддегидрогеназу (ALDH). Превращение в формиат с помощью ALDH происходит полностью, без обнаруживаемого формальдегида. Формиат токсичен, потому что он ингибирует митохондриальную цитохром-с-оксидазу , вызывая гипоксию на клеточном уровне и метаболический ацидоз среди множества других метаболических нарушений.
Вспышки отравления метанолом произошли в основном из-за заражения употребляемого алкоголя . Это чаще встречается в развивающихся странах . Тем не менее, в 2013 году в США было зарегистрировано более 1700 случаев. Пострадавшие часто бывают взрослыми мужчинами. При раннем лечении результаты могут быть хорошими. Токсичность метанола была описана еще в 1856 году.
Из-за своих токсичных свойств метанол часто используется в качестве денатурирующей добавки для этанола, производимого для промышленного использования. Это добавление метанола освобождает промышленный этанол (широко известный как « денатурированный спирт » или «метилированный спирт») от акцизного налогообложения спиртных напитков в США и некоторых других странах.
В ходе COVID-19 пандемии , то за продуктами и лекарствами США обнаружили ряд дезинфицирующее продуктов , продаваемых , которые были помечены как содержащие этанол , но имели положительную реакцию на загрязнение метанола. Из-за токсического воздействия метанола при всасывании через кожу или проглатывании, в отличие от относительно более безопасного этанола, FDA распорядилось отозвать такие дезинфицирующие средства для рук, содержащие метанол, и выпустило предупреждение об импорте, чтобы остановить незаконный выход этих продуктов на рынок США. .
История
В процессе бальзамирования древние египтяне использовали смесь веществ, в том числе метанол, которые они получали при пиролизе древесины. Однако чистый метанол был впервые выделен в 1661 году Робертом Бойлем , когда он получил его путем дистилляции самшита (самшита). Позже он стал известен как «пироксилиновый спирт». В 1834 году французские химики Жан-Батист Дюма и Эжен Пелиго определили его элементный состав.
Они также ввели слово «метилен» в органическую химию, образовав его от греческого слова methy = «спиртовая жидкость» + = «лес, древесина, древесина, материал». «Метилен» обозначает «радикал», который содержит около 14% водорода по массе и содержит один атом углерода. Это был бы CH 2 , но в то время считалось, что углерод имеет атомную массу всего в шесть раз больше, чем водород, поэтому они дали формулу как CH. Затем они назвали древесный спирт (l’esprit de bois) «бигидрат метилена» (бигидрат, потому что они думали, что формула была C 4 H 8 O 4 = (CH) 4 (H 2 O) 2 ). Термин «метил» был получен примерно в 1840 году путем обратного образования «метилена», а затем был применен для описания «метилового спирта». Это было сокращено до «метанола» в 1892 году Международной конференцией по химической номенклатуре . Суффикса -ил , который, в органической химии , образует имена углеродных групп, от слова метил .
Французский химик Поль Сабатье представил первый процесс, который можно было использовать для синтетического производства метанола в 1905 году. Этот процесс предполагал, что диоксид углерода и водород могут реагировать с образованием метанола. Немецкие химики Альвин Митташ и Матиас Пьер, работающие в компании Badische-Anilin & Soda-Fabrik (BASF), разработали средство для преобразования синтез-газа (смеси оксида углерода , диоксида углерода и водорода ) в метанол и получили патент. Согласно Боццано и Маненти, процесс BASF был впервые использован в Лойне , Германия, в 1923 году. Рабочие условия включали «высокие» температуры (от 300 до 400 ° C) и давления (от 250 до 350 атм) с катализатором на основе оксида цинка / хрома. .
Патент США 1569775 ( ) был подан 4 сентября 1924 г. и выдан 12 января 1926 г. компании BASF; В процессе использовался катализатор на основе оксида хрома и марганца в чрезвычайно жестких условиях: давление в диапазоне от 50 до 220 атм и температура до 450 ° C. Современное производство метанола стало более эффективным за счет использования катализаторов (обычно медных), способных работать при более низких давлениях. Современный процесс метанола низкого давления (LPM) был разработан ICI в конце 1960-х годов в действия технологического патента истек.
Во время Второй мировой войны метанол использовался в качестве топлива в нескольких конструкциях немецких военных ракет под названием M-Stoff и в смеси примерно 50/50 с гидразином , известной как C-Stoff .
Использование метанола в качестве моторного топлива привлекло внимание во время нефтяного кризиса 1970-х годов. К середине 1990-х в США было введено более 20 000 метанольных « гибких топливных транспортных средств » (FFV), способных работать на метаноле или бензине
Кроме того, низкие уровни метанола добавлялись в бензиновые топлива, продаваемые в Европе в течение большей части 1980-х годов и начало 1990-х гг. К концу 1990-х автопроизводители прекратили производство метанольных FFV, переключив свое внимание на автомобили, работающие на этаноле. Хотя программа FFV метанола имела технический успех, рост цен на метанол в середине-конце 1990-х годов в период падения цен на бензиновые насосы снизил интерес к метанольному топливу.
В начале 1970-х годов процесс был разработан Mobil для получения бензина топливо из метанола.
Между 1960-ми и 1980-ми годами метанол появился в качестве предшественника исходных химических веществ уксусной кислоты и уксусного ангидрида . Эти процессы включают в себя синтез Монсанто уксусной кислоты , процесс Cativa , и .
Что предпринять при отравлении
Если у человека проявились симптомы спиртовой интоксикации, необходимо действовать незамедлительно. Неотложная помощь при отравлении метилом состоит в нормализации сердечно-сосудистой деятельности, функционирования почек и дыхательных органов.
Хотя без помощи медработников в бытовых условиях невозможно провести все терапевтические мероприятия по борьбе с токсичным действием метанола, пострадавшему крайне важно оказать необходимую помощь. Прежде всего следует выполнить промывание желудка поэтапно:
Прежде всего следует выполнить промывание желудка поэтапно:
- Дать человеку достаточное количество тёплой воды;
- Надавить небольшой ложкой на корень языка для вызова рвотного рефлекса;
- Если больной находится без сознания, стоит уложить его набок во избежание случайного попадания рвоты в органы дыхания;
- Повторять действия до тех пор, пока желудок не очистится полностью.
После промывания до приезда врачей необходимо давать пострадавшему много жидкости и щелочные растворы. Затем стоит предложить больному качественный этанол или алкоголь высокой крепости в количестве 0,5 мл или 1 мл на килограмм массы тела.
Действительно этиловый спирт — это антидот метилового. Эти спирты при попадании в организм оказывают воздействие на одинаковые рецепторы и ферменты, но токсичность этанола несравнимо ниже, и этим обосновывается использование качественного пищевого спирта в качестве противоядия.
Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ:Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
CH3-OH + CuO → CH2O + H2O + Cu
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
2CH3-OH + O2 → 2CH2=O + 2H2O
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
| Например, уравнение сгорания метанола: |
2CH3OH + 3O2 = 2CO2 + 4H2O
Первая помощь
При попадании Метилового спирта в глаза необходимо промыть их сильной струей воды, при загрязнении кожи — быстро смыть с нее М. с. водой и сменить одежду.
При приеме Метилового спирта внутрь необходимо немедленно начать промывание желудка и продолжать его в течение первых 2 часов, необходимо также начать борьбу с ацидозом путем введения внутрь 2—4 л и внутривенно 1 л 5% р-ра гидрокарбоната натрия (питьевой соды). Внутривенно вводят 5% р-р этилового спирта, к-рый, конкурируя с М. с. за окислительные ферменты, задерживает образование в организме токсичных метаболитов М. с. По показаниям — заменное переливание крови, гемосорбция (см. Гемосорбция), вдыхание мед. кислорода, сердечные средства.
Аналогичные меры принимают при отравлении суррогатами винного спирта, содержащими примесь М. с. (см. Денатурированный спирт).
Получение метилового спирта
Метиловый спирт получают из природного газа, который состоит в основном из метана. Существует несколько способов получения метилового спирта: перегонка лигнина и древесного сырья, разложение соли метановой кислоты, из метана и синтез-газа. Ежегодное мировое производства метанола – это примерно 60 млн тонн.
Каталитическое получение метилового спирта – сложный процесс, суммарная реакция может быть представлена в следующем виде:
СО – 2Н2 → СН3ОН.
Естественные источники получения
Наиболее распространен способ получения метилового спирта из природного газа, который состоит в основном из метана.
Искусственные источники получения
гидролиз
CH3Br + NaOHaq→CH3OH + NaBr (t0);
каталитическое окисление метана
2CH4 + O2→ 2CH3OH (p, t0);
гидрирование муравьиного альдегида
H-C(O)H + H2→CH3OH (kat = Ni, t0).
Общее описание аппарата для изготовления бензина из воды и бытового газа
Получаемая при помощи данного аппарата жидкость — метанол (метиловый спирт).
Как известно, метанол в чистом виде применяется в качестве растворителя и как высооктановая добавка к моторному топливу, он также является самым высокооктановым (октановое число равно 150) бензином. Это тот самый бензин, которым заправляют баки гоночных мотоциклов и автомобилей. Как показывают зарубежные исследования, двигатель, работающий на метаноле, служит во много раз дольше, чем при использовании обычного автобензина, мощность его повышается на 20%. Выхлоп двигателя, работающего на этом топливе, экологически чист, и при проверке выхлопных газов на токсичность вредные вещества в них практически отсутствуют.
Аппарат для получения метанола прост в изготовлении, не требует особых знаний и дефицитных деталей, безотказен в работе, имеет небольшие габариты. Кстати, его производительность, зависящая от многих причин, в том числе определяется и его габаритами. Аппарат, схему и описание сборки которого предлагаем вашему вниманию, при наружном диаметре смесителя D = 75 мм дает 3 л готового топлива в час, масса собранного аппарата около 20 кг, габариты его приблизительно следующие: высота — 20 см, длина — 50 см, ширина — 30 см.
Внимание: метанол является сильным ядом. Он представляет собой бесцветную жидкость с температурой кипения 65°С, имеет запах, подобный запаху обычного питьевого спирта, смешивается во всех отношениях с водой и многими органическими жидкостями
Помните о том, что 30 мм выпитого метанола смертельны! Понятно, что и обычный бензин опасен не меньше.
Как выявить метанол в алкоголе
Прим малейших сомнениях в составе спиртного напитка рекомендуются подстраховаться и выявить отличия метанола от этанола.
Простой и наглядный способ — отрезать ломтик сырой картошки и поместить в вещество. Корнеплод, подвергнувшийся воздействию технического спирта, обретёт розовую окраску, а пищевого спирта — не изменит цвет. Для проявления результата необходимо выждать около двух-трёх часов.
Ещё способ — попробовать поджечь продукт. Метиловый спирт загорается зелёным огнём, а этанол — синим. Но все люди отчётливо замечают разницы между этими цветами пламени.
Наиболее показательный метод — использовать формальдегидную пробу. Проволоку из меди следует добела нагреть на огне и опустить в жидкость. Если чувствуется подозрительный запах, пить такой «напиток» из метилового спирта определённо не стоит.
Отравления
Острые и хронические отравления Метиловым спиртом возникают при превышении предельно допустимой концентрации его паров в воздухе, а также при попадании М. с. на незащищённую кожу или при сильном загрязнении спецодежды и обуви. Особенно опасен прием М. с. внутрь вместо этилового спирта: 5—10 мл М. с. могут вызвать тяжелое отравление, а 30 мл — привести к смертельному исходу.
При хрон, отравлении М. с. нарушаются окислительно-восстановительные процессы в головном мозге, появляются изменения сосудов головного мозга и особенно сосудов органа зрения, приводящие к изменениям и частичной гибели фоторецепторных, ганглиозных клеток сетчатки (см.), разрастанию глии, дегенеративным изменениям нейронов в центральной части зрительного анализатора (см.). При отравлении М. с. развиваются дистрофические изменения в печеночных клетках, что ведет к стойкой функциональной неполноценности печени, не исчезающей после клин, выздоровления.
Хрон, отравление малыми концентрациями М. с. характеризуется головокружением, головной болью, бессонницей, повышенной утомляемостью, жел.-киш. расстройствами, ухудшением зрения, прежде всего цветового. При хрон, воздействии паров М. с. в концентрации 50 мг/м3 и выше у работающих на производстве, связанном с получением или использованием М. с., выявлены функциональные изменения органа зрения.
Острое отравление М. с. характеризуется состоянием легкого опьянения, тошнотой, рвотой, сильной головной болью, резким ухудшением зрения вплоть до слепоты, при утяжелении состояния появляются цианоз, затрудненное дыхание, расширение зрачков, судороги и смерть от остановки дыхания. Диагноз подтверждается обнаружением в моче муравьиной к-ты, а также анализом рвотных масс и недопитой жидкости.
Метиловый спирт в судебно-медицинском отношении
Отравления Метиловым спиртом нередко бывают групповыми; обычно пострадавшие недостаточно информированы о ядовитости М. с. или пренебрегают ею. Смертельная доза при приеме внутрь 30—100 мл.
Цатологоанатомические изменения характерны для острой смерти и свидетельствуют о поражении сосудистой системы (выраженное полнокровие со стазами и мелкими множественными кровоизлияниями в головной мозг и другие внутренние органы, кровоизлияния в серозные и слизистые оболочки, темная «дегтеобразная» кровь в крупных сосудах и синусах твердой мозговой оболочки и др.). Наблюдаются симметричные очаги размягчения в головном мозге, в области внутренней капсулы, полосатого тела, иногда мозжечка. Распределение М. с. во внутренних органах зависит от относительного содержания в них воды, поэтому для хим. исследования берут кровь, мочу, цереброспинальную жидкость, почку, печень, мозг и желудок с содержимым. М. с. быстро всасывается и медленно окисляется, в крови максимальная его концентрация создается через 4—16 час.; длительнее всего М. с. сохраняется в цереброспинальной жидкости — до 12 дней.
М. с. частично выделяется слизистой оболочкой желудка, поэтому в промывных водах и рвотных массах его можно обнаружить в течение 2 сут. Муравьиная к-та — ядовитый метаболит М. с. — содержится в крови, моче, печени, почках и мозге. С мочой она выделяется в течение 5—6 дней.
Для суд.-хим. обнаружения Метилового спирта используют метод газожидкостной хроматографии (см.).
Библиография: Бережной Р. В. Судебно-медицинская экспертиза отравлений техническими жидкостями, с.26, М., 1977; Вредные вещества в промышленности, под ред. Н. В. Лазарева и Э. Н. Левиной, т. 1, с. 363, Л., 1976; Гадаскина И. Д. и Филов В. А. Превращения и определение промышленных органических ядов в организме, с. 232, Л., 1971; Егоров Ю. Л. и др. Состояние органа зрения работающих в производстве синтетических жирных кислот и спиртов и вопросы гигиенического нормирования содержания спиртов в воздухе, Гиг. труда и проф. заболев., № 11, с. 33, 1966; Несмеянов А. Н. и Несмеянов Н.А. Начала органической химии, кн. 1, М., 1974; Робертс Дж. и Касерио М. Основы органической химии, пер. с англ., т. 1, с. 405, М., 1978; Розенбаум Н.Д. Гигиена труда при работе с органическими растворителями, Свердловск, 1946; Mосsсhlin S. Klinik und Therapie der Vergiftungen, Lpz., 1964.
В. И. Розенгарт; Ю. Л. Егоров, P. В. Бережной (суд.).
Что такое летальный синтез?
Ему подвергается до 95% метанола. Это биотрансформация метилового спирта в формальдегид. Продукт, в 30 с лишним раз более токсичный. Формальдегид окисляется в муравьиную кислоту. Выводятся метаболиты и часть неизменённого метанола в основном почками (ещё лёгкими, потовыми железами). Концентрация метаболитов в крови выше, чем исходного яда. Основная переработка производится в печени ферментом алкогольдегидрогеназой (АДГ). Она метаболизирует и этанол, но превращение метилового спирта идёт в 7 раз медленнее, поэтому токсическое влияние на организм растягивается на несколько суток.

Получение предельных одноатомных спиртов
К наиболее часто используемым химическим способам получения спиртов относятся:
1.Гидратация алкенов (промышленный способ получения этанола для технических целей)
(t, Р, кислая среда (катализатор))
2.Щелочной гидролиз галогеналканов (лабораторный способ получения)
(водный раствор щелочи, t)
3.Восстановление альдегидов и кетонов (лабораторный способ получения)
(t, катализатор –Ni)
Особые способы получения метанола и этанола
1.Получение метанола из синтез-газа (водяной газ, генераторный газ)
(t, Р, оксидные катализаторы)
2.Получение этанола ферментативным брожением глюкозы (получение этилового спирта для пищевых и медицинских целей)
(ферменты — дрожжи)
1. Гидратация алкенов
Гидратация алкенов используется в промышленности для получения спиртов из продуктов нефтепереработки.
Присоединение воды к алкенам происходит в присутствии разбавленной серной или фосфорной кислот. Эта реакция протекает в соответствии с правилом Марковникова, поэтому первичный спирт можно получить только из этилена, а остальные алкены дают вторичные или третичные спирты: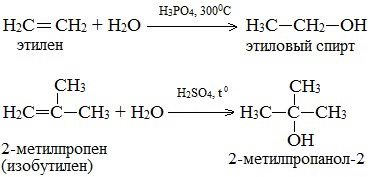
Этот метод в лабораторных условиях нашел ограниченную область применения для получения третичных спиртов.
2. Гидролиз галогеналканов в водном растворе щелочи
В лабораторных условиях спирты получают действием водного раствора щелочи на алкилгалогениды при нагревании, при этом атом галогена в галогеналкане замещается группой –ОН:
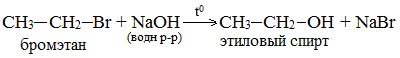
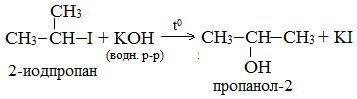
С помощью этой реакции можно получать первичные, вторичные и третичные спирты.
При действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена.
3. Восстановление карбонильных соединений (альдегидов и кетонов)
Дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция – гидрирование альдегидов, кетонов и эфиров карбоновых кислот – является, таким образом, их восстановлением.
При действии водорода в присутствии катализаторов (Ni, Pt, Pd) альдегиды восстанавливаются до первичных спиртов, а кетоны – до вторичных спиртов: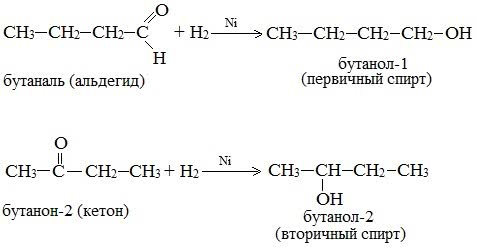
4. Восстановление эфиров карбоновых кислот
Гидрирование сложных эфиров проходит через стадию образования альдегидов:
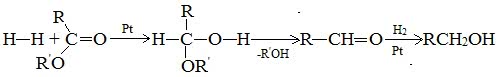
Этим методом в промышленности из метиловых эфиров высших кислот получают высшие первичные спирты, например:
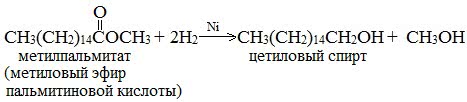
5. Гидролиз сложных эфиров карбоновых кислот в щелочной среде
Гидролиз сложных эфиров карбоновых кислот протекает как в кислой, так и в щелочной среде (водные или спиртовые растворы NaOH, КОН, а также Ba (OH)2, Ca (OH)2, Ba (OH)2, Ca (OH)2). Однако к образованию спиртов приводит гидролиз, протекающий необратимо в щелочной среде:
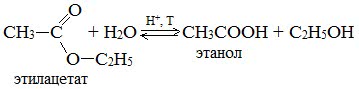
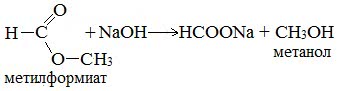
6. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
Спирты образуются при многочисленных реакциях металлоорганических соединений с различными соединениями, содержащими карбонильную группу >С=О. Этим способом можно получать как первичные спирты, так и вторичные и третичные:
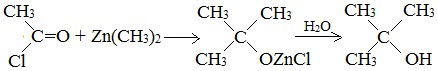
7. Окисление алканов
При мягком окислении метана кислородом воздуха в присутствии различных катализаторов образуются метанол, формальдегид или муравьиная кислота:
Специфические способы получения метанола и этанола
Производство метанола крупнотоннажное, т.к. метиловый спирт является исходным веществом для получения других продуктов органического синтеза.
В промышленности
1. Получение метанола из синтез-газа (водяной газ, генераторный газ)
а) Конверсия природного газа в синтез-газ
Его получают из метана с перегретым водяным паром:
б) Каталитический синтез метанола из оксида углерода (II) и водорода
В качестве катализаторов используют смесь оксидов цинка, меди и хрома, температуру поддерживают в интервале 200-300 оС, а давление – от 40 до 150 атм.
Газ на выходе из реактора содержит 3-5% CH3OH, затем газ охлаждают и конденсируют полученный метанол, а оставшийся газ смешивают с исходным газом и направляют снова в реактор.
Ранее метанол получали сухой перегонкой древесины без доступа воздуха (отсюда его название «древесный спирт»).
2. Получение этанола спиртовым брожением глюкозы
Ферментативный гидролиз крахмала – наиболее древний синтетический процесс, используемый человеком – до сих пор имеет огромное значение для получения этилового спирта.
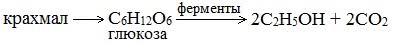
Протекает только в присутствии ферментов, которые вырабатывают некоторые микроорганизмы, например, дрожжи:
Глюкоза содержится во фруктовых соках. Глюкозу можно получить гидролизом крахмала (зерно, картофель, целлюлозные опилки):
Рубрики: Спирты Теги: Спирты