Применение серы
Применяют серу для лечения человека с древних времен. Современная медицина использует ряд лекарственных средств, содержащих этот элемент и его соединения. Например:
- природные ванны из сероводорода благоприятно влияют на организм;
- раствор тиосульфата натрия используют для лечения чесотки, невралгии, артрита;
- стрептоцид и фталазол служат антисептическими препаратами.
Серу используют для производства лечебного мыла, которое обладает антисептическим и подсушивающим эффектом. Очищенную, или медицинскую серу, используют для борьбы с паразитами, при заболеваниях кишечника и частых запорах.
Сера применяется для лечения экземы, фурункулеза и демодекоза. Из нее делают маски для волос и против перхоти: элемент выступает стимулятором роста волос, а также устраняет их жирность.
Особенности усвоения макроэлемента
Сера прекрасно усваивается из пищи. Но чтобы усвояемость была еще более высокой, стоит употреблять ее пищевые источники с белками и животными жирами.
Для хорошего усвоения макроэлемента также важно достаточное количество биотина, аскорбиновой кислоты, железа и фтора. А вот переизбыток селена, молибдена, свинца и бария, наоборот, ухудшают всасываемость минерала
Сера в продуктах содержится в достаточном количестве и хорошо усваивается организмом. Поэтому дополнительно принимать ее в виде добавок не стоит. Если, конечно, прием не был назначен врачом
В лечении дерматологических заболеваний, помимо правильного рациона, важно применение серосодержащих кремов, мазей
Подписывайтесь на блог! Читайте о полезных свойствах витаминов и минералов, а также об их основных пищевых источниках!
- Новиков А. Ф. МСМ: Сера – наш спутник на пути к здоровью. Москва, 2014.
- Ребров В. Г., Громова О. А. Витамины, макро- и микроэлементы. М.: ГЭОТАР-Медиа, 2008. – 960 c.
- Елоева Д. В., Неелова О. В. Биологическая роль серы и применение ее соединений в медицине // Успехи современного естествознания. – 2014. – № 8.
Применение
Фитотоксичность. При температуре более 35 °С препараты серы повреждают растения (ожоги листьев, иногда их опадение), поэтому при более высоких температурах используют меньшую норму расхода.Тыквенные культуры и некоторые сорта крыжовника имеют повышенную чувствительность к препаратам серы – у них возможны ломкость и огрубение листьев, их опадение, ожоги.
Нельзя применять серу, когда растения страдают от засухи.
Жидкие формы
В сельском хозяйстве. В 80-х годах сера и ее соединения были одними из наиболее важных неорганических пестицидов. В тонко измельченном состоянии или в виде коллоидных препаратов сера широко применяется для борьбы с растительноядными клещами и мучнисторосяными грибами.
В сельском и личных подсобных хозяйствах фунгициды на основе серы применяются против возбудителей заболеваний винограда (оидиум), яблони, груши, айвы (мучнистая роса, парша, ржавчина), томатов и огурцов открытого и защищенного грунта, кабачков (мучнистая роса), крыжовника, смородины черной (американская мучнистая роса) розы открытого и защищенного грунта (мучнистая роса).
Баковые смеси. Нельзя применять препараты на основе серы в течение 15 дней до и 15 дней после обработки растений минеральными маслами и с эмульсиями нефтяных масел. Можно применять совместно с большинством препаратов (кроме нефтяных и минеральных масел или содержащих в своем составе масла).
Применение серы
Среди вещей, окружающих нас, мало таких, для изготовления которых не нужны были бы сера и ее соединения. Бумага и резина, эбонит и спички, ткани и лекарства, косметика и пластмассы, взрывчатка и краска, удобрения и ядохимикаты — вот далеко не полный перечень вещей и веществ, для производства которых нужен элемент № 16. Для того чтобы изготовить, например, автомобиль, нужно израсходовать около 14 кг серы. Можно без преувеличения сказать, что промышленный потенциал страны довольно точно определяется потреблением серы.
Применение серы (спички)
За недостатком места мы коротко перечислим лишь несколько отраслей производства, в которых не обойтись без элемента № 16 в виде простого вещества.
Значительную часть мировой добычи серы поглощает бумажная промышленность (соединения серы помогают выделить целлюлозу). Для того чтобы произвести 1 т целлюлозы, нужно затратить более 100 кг серы. Много элементной серы потребляет и резиновая промышленность — для вулканизации каучуков.
В сельском хозяйстве сера применяется как в элементном виде, так и в различных соединениях. Она входит в состав минеральных удобрений и препаратов для борьбы с вредителями. Наряду с фосфором, калием и другими элементами сера необходима растениям. Впрочем, большая часть вносимой в почву серы не усваивается ими, но помогает усваивать фосфор. Серу вводят в почву вместе с фосфоритной мукой. Имеющиеся в почве бактерии окисляют ее, образующиеся серная и сернистая кислоты реагируют с фосфоритами, и в результате получаются фосфорные соединения, хорошо усваиваемые растениями.
Однако основной потребитель серы — химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить 1 т H2SO4, нужно сжечь около 300 кг серы. А роль серной кислоты в химической промышленности сравнима с ролью хлеба в нашем питании.
Значительное количество серы (и серной кислоты) расходуется при производстве взрывчатых веществ и спичек. Чистая, освобожденная от примесей сера нужна для производства красителей и светящихся составов.
Соединения серы находят применение в нефтехимической промышленности. В частности, они необходимы при производстве антидетонаторов, смазочных веществ для аппаратуры сверхвысоких давлений; в охлаждающих маслах, ускоряющих обработку металла, содержится иногда до 18% серы.
Перечисление примеров, подтверждающих первостепенную важность элемента № 16, можно было бы продолжить, но «нельзя объять необъятное». Поэтому вскользь упомянем, что сера необходима и таким отраслям промышленности, как горнодобывающая, пищевая, текстильная, и — поставим точку
Наш век считается веком «экзотических» материалов — трансурановых элементов, титана, полупроводников и так далее. Но внешне непритязательный, давно известный элемент № 16 продолжает оставаться абсолютно необходимым. Подсчитано, что в производстве 88 из 150 важнейших химических продуктов используют либо саму серу, либо ее соединения
Это ли не свидетельство первостепенной важности элемента № 16? Элемента, древнего как мир…
Маленькое чудо природы – биотин (B7)
Исследователи обратили внимание на то что в организме человека сера отлично взаимодействует с витаминами С и В7 (биотин), который является еще и дополнительным источником серы, транспортным средством для нее. Биотин – от греческого «bios» («жизнь») – маленькое чудо природы, был открыт П
Дьёрдем в 1931 году. Свое название получил из-за способности стимулировать рост дрожжей и бактерий. Биотином называют группу из 8 соединений, похожих по своим биологическим и химическим свойствам
Биотин – от греческого «bios» («жизнь») – маленькое чудо природы, был открыт П. Дьёрдем в 1931 году. Свое название получил из-за способности стимулировать рост дрожжей и бактерий. Биотином называют группу из 8 соединений, похожих по своим биологическим и химическим свойствам.
Биотин играет важную роль в обмене веществ в целом, способствует стабилизации содержания глюкозы в крови, улучшает питание головного мозга и функционирование нервной системы.
Исследования показали, что биотин нормализует функцию кожи и лизистых оболочек, предотвращает появления угрей и камедонов, способствует устранению мелких морщин кожи лица, шелушений, себореи кожи головы. «Работа» биотина помогает сохранять кожу здоровой, защищая от дерматитов, предохранить волосы от седины и замедляет процессы старения в организме.
Биотин – витамин молодости и красоты. Известно, что кожа, ногти и волосы состоят в основном из белка кератина. Биотин поддерживает достаточное количество этого белка в организме и способствует улучшению состояния волос и кожи, предупреждает раннее поседение волос, укрепляет структуру ногтей, устраняет их ломкость и расслоение.
Химические свойства Серы
Конфигурация внешних электронов атома S 3s2Зр4. В соединениях Сера проявляет степени окисления -2, +4, +6. Сера химически активна и особенно легко при нагревании соединяется почти со всеми элементами, за исключением N2, I2, Au, Pt и инертных газов. С О2 на воздухе выше 300 °С образует оксиды: SO2 — сернистый ангидрид и SO3— серный ангидрид, из которых получают соответственно сернистую кислоту и серную кислоту, а также их соли сульфиты и сульфаты.
Уже на холоду S энергично соединяется с F2, при нагревании реагирует с Cl2; с бромом Сера образует только S2Br2, иодиды серы неустойчивы. При нагревании (150-200 °С) наступает обратимая реакция с Н2 с получением сернистого водорода. Сера образует также многосернистые водороды общей формулы H2SХ, так называемые сульфаны. Известны многочисленные сераорганические соединения.
При нагревании Сера взаимодействует с металлами, образуя соответствующие сернистые соединения (сульфиды) и многосернистые металлы (полисульфиды). При температуре 800-900 °С пары Серы реагируют с углеродом, образуя сероуглерод CS2. Соединения Серы с азотом (N4S4 и N2S5) могут быть получены только косвенным путем.
Физико-химические свойства
Сера – мягкий, хрупкий минерал, не растворяется в воде и неокисляющих кислотах. Природные кристаллы серы чувствительны к свету и теплу, их необходимо хранить в темном, прохладном и сухом месте. При нормальных условиях сера является твердым веществом без запаха. Существует несколько неметаллических модификаций серы.
Кристаллы серы показывают типичные формы ромбической системы, такие как пинакоиды, призмы или дипирамиды. Прозрачные, неповрежденные, хорошо сформированные кристаллы в форме бочек или толстых брусков очень популярны среди коллекционеров.
Ромбическая сера также называется α-серой. При нагревании от 95,2 C она превращается в желтый жидкий расплав, и получается λ-сера. Если смесь продолжать нагревать от 159 С она постепенно становится вязкой, образуя при 200 С μ-серу. Свыше 250 C вязкость уменьшается, температура кипения составляет 444 C.
Если расплавленная сера затвердевает на поверхности в больших тиглях, образуются длинные моноклинные кристаллические иглы. Эта модификация называется моноклинной серой или β-серой. Когда она остывает до температуры ниже 115,2 C, то медленно превращается обратно в ромбическую серу.
Если наливать жидкий расплав в стакан с холодной водой, образуются эластичные нити или желто-коричневая вязкая масса, которая называется пластичной серой, которая затем постепенно превращается обратно в ромбическую серу.
Сера очень реактивна и образует химические соединения со многими элементами. Исключение составляют золото, платина, иридий, азот, теллур, йод и благородные газы. На воздухе сера горит голубоватым пламенем с образованием токсичного и едко пахнущего газа диоксида серы (SO2).
Когда диоксид серы растворяется в воде, образуется раствор диоксида серы и, в небольших количествах, серная кислота.
Сера подвергается воздействию окисляющих кислот, таких как концентрированная азотная кислота. Другими важными соединениями серы являются серная кислота и ее соли, сульфаты.
Альфа-сера является наиболее стабильной формой. Ее также называют ромбической серой. Эта модификация образует лимонно-желтые, довольно хрупкие кристаллы.
Бета-сера образуется из альфа-серы при нагревании до 95 С. Из-за кристаллической формы эта модификация также называется «моноклинной» серой. Моноклинная сера обладает светло-желтым цветом.
Сера становится жидкой при 113 С (ромбическая) или при 119 С (моноклинная). Сначала жидкость становится желтой, а при дальнейшем нагревании темно-коричневой. Если сера нагревается до температуры выше 400 C, вязкий расплав снова становится жидким. Жидкая сера кипит при 445 С.
Сублимированная сера получается путем охлаждения паров серы (светло-желтый порошок). Однако, если расплав быстро охлаждается (закалка), образуется пластичная сера.
Сера не вступает в реакцию с водой. Горит голубоватым пламенем при температуре около 250 C, производя едкие газы (диоксид серы). Сера реагирует со многими другими элементами, например, с водородом до сероводорода или с металлами до сульфидов (например, сульфид железа).
Общие данные
Расположение в периодической таблице Д.И. Менделеева: в старой версии — III период, III ряд, VI группа, в новой версии таблицы – 16 группа, 3 период.
- Атомный номер – 16
- Атомная масса – 32,059 а. е. м.
- Электронная конфигурация – 3s2 3p4
- Температура плавления (°С) – 112,85 (386 K)
- Температура кипения (°С) – 444,67 (717,824 К).
- CAS: 7704-34-9.
Физико-химические свойства. Чистая сера – желтые прозрачные и полупрозрачные кристаллы, которые без особого труда легко измельчить в состояние порошка. При наличии примесей может иметь оранжевый, желто-коричневый, бурый и даже черный цвета. Обычно в ней присутствуют добавки глины, сульфатов, карбонатов, битумов и прочих веществ. Блеск маслянистый, жирный.
В природе представлена 2мя формами – α-сера и β-сера. Альфа характеризуется ромбическим видом кристаллов и стойкую структуру при температуре до 96 °С. При воздействии более высоких температур альфа-сера перерождается в бета-серу, которая уже имеет моноклинные кристаллы и становится устойчивой к более высоким температурам. Плотность минерала — 2,05 -2,08 г/см3.

В воде сульфур за счет гидрофобных свойств не тонет, хотя этот минерал и тяжелее H2O. Однако при добавлении немного спирта или ацетона опускается на дно. Кстати, из-за того, что сульфур находится в составе многих солей и кислот, они также плохо растворяются водой. Сера хорошо растворима в керосине, скипидаре, сероуглероде и канадском бальзаме.
При нагревании S постепенно плавится, преобразовываясь в желтую подвижную жидкость, и при дальнейшем увеличении температуры нагревания до 160 °С желтый цвет сменяется оранжевым, после темно-красным, далее, при 190 °С немного загустевает и через время, при 300 °С снова становится подвижным.
Сера, как простое вещество
Молекула S2 имеет строение, аналогичное O2.
В отличие от кислорода, сера может образовывать зигзазообразные цепи, но наиболее устойчивыми являются циклические молекулы серы, имеющие форму короны, в которую входят 8 атомов (S8) — α-сера. «Короны» с меньшим числом атомов менее устойчивы. Кроме этого, молекулы серы могут образовывать открытые цепи (S∞).
В ромбической модификации S8 — 8 атомов серы соединены между собой одинарными ковалентными связями — это твердые кристаллы желтого цвета, нерастворимые в воде, но хорошо растворяющиеся в органических растворителях, например, в сероуглероде.
Сера при высоких температурах может существовать в газообразном состоянии:
- S8
- S6 — 450°C
- S4 — 650°C
- S2 — 900°C
- S — 1500°C
Описание и внешние признаки
Она образовывается в соляных шахтах, в качестве отложений вокруг вулканов и внутри осадочных слоев
Серная кислота, основное производное серы, — это наиболее важное неорганичное химическое вещество, которое используется в торговле, химии и производстве удобрений. Раньше считалось, что потребление кислоты является одним из лучших показателей промышленного развития страны
Цвет минерала схож с цветом поверхности спутника Юпитера Ио, что объясняется вулканическими процессами, в следствии которых образовывается сера.
Английское название сульфур (sulfur) происходит от латинского слова, которое в переводе значит “сера”.
По классификации Dana Class принадлежит к классу самородных элементов с полуметаллическими и неметаллическими элементами, группа полиморфов.
Классификация
Подвидом серы является росицкит — необычный полиморф минерала. Он кристаллизуется в моноклинной системе, тогда как кристаллы серы — орторомбические.
Химический состав
Самородная сера состоит из одноименного химического элемента (S8). В периодической системе химических элементов имеет атомный номер 16. Молекулярный вес составляет 256,53 г.
Физические свойства
- твердость по шкале твердости минералов Мооса: 2 (схож с гипсом);
- удельный вес: 2;
- плотность: 2,05-2,09 (средний показатель — 2,06);
- прозрачность: от прозрачных до полупрозрачных самородков;
- цвет: желтый, коричнево- или зелено-желтый, оранжевый, белый;
- цвет черты: белый;
- блеск от стеклянного до земляничного;
- расщепление (излом): конхоидальный (раковистый), неровный;
- габитус: призматический, порошкообразный, имеет форму почки (как, например, гематит);
- люминесцентность: не флуоресцентный.
Оптические показатели
| Параметры | Характеристики |
| Показатель преломления | 1.958 |
| Максимальное двулучепреломление | 0.287 |
| Рассеивание света | низкое |
| Плеохроизм | наблюдается |
Следует отметить, что низкий коэффициент электропроводности влияет на хрупкость минерала при нагревании.
Аллотропные модификации серы
α-сера
Рис. Ромбическая α-сера.
α-сера:
- кристаллическое вещество желтого цвета;
- устойчиво при комнатной температуре;
- состоит из циклических молекул S8.
- температура плавления = 112,8°C;
- плотность = 2,06 г/см3.
β-сера
Рис. Моноклинная β-сера.
β-сера:
- темно-желтые кристаллы;
- устойчиво при температуре 95°C и выше;
- от альфа-серы отличается ориентацией кольцевых молекул в узлах кристаллической решетки;
- температура плавления = 119,3°C;
- плотность = 1,957 г/см3.
Пластическая сера
 Рис. Пластическая сера.
Рис. Пластическая сера.
Пластическая сера:
- резиноподобное вещество темно-коричневого цвета;
- образуется при резком охлаждении расплавленной серы;
- состоит из открытых цепных полимерных молекул (S∞);
- плотность = 2,046 г/см3.
Происхождение серы
Встречается самородная сера естественного и вулканического происхождений. Серобактерии живут в водных бассейнах, обогащенных сероводородом за счет разложения органических остатков, — на дне болот, лиманов, мелких морских заливов. Лиманы Черного моря и залив Сиваш являются примерами таких водоемов. Концентрация серы вулканического происхождения приурочена к жерлам вулканов и к пустотам вулканических пород. При вулканических извержениях выделяются различные соединения серы (H 2 S, SО 2), которые окисляются в поверхностных условиях, что приводит к восстановлению ее; кроме того, сера возгоняется непосредственно из паров.
Иногда при вулканических процессах сера изливается в жидком виде. Это бывает тогда, когда сера, ранее осевшая на стенках кратеров, при повышении температуры расплавляется. Отлагается сера также из горячих водных растворов в результате распада сероводорода и сернистых соединений, выделяющихся в одну из поздних фаз вулканической деятельности. Эти явления сейчас наблюдаются около жерл гейзеров Йеллоустонского парка (США) и Исландии. Встречается совместно с гипсом, ангидритом, известняком, доломитом, каменной и калийной солями, глинами, битуминозными отложениями (нефть, озокерит, асфальт) и пиритом. Также встречается на стенках кратеров вулканов, в трещинах лав и туфов, окружающих жерла вулканов как действующих, так и потухших, вблизи серных минеральных источников.
Спутники
. Среди осадочных пород: гипс, ангидрит, кальцит, доломит, сидерит, каменная соль, сильвин, карналлит, опал, халцедон, битумы (асфальт, нефть, озокерит). В месторождениях, образовавшихся в результате окисления сульфидов, — главным образом пирит. Среди продуктов вулканического возгона: гипс, реальгар, аурипигмент.
Физические свойства
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами. В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде, скипидаре. Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться. Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
Месторождения серы
На территории Евразии все промышленные месторождения самородной серы поверхностного происхождения. Некоторые из них находятся в Туркмении, в Поволжье и др. Породы, содержащие серу, тянутся вдоль левого берега Волги от г. Самара полосой, имеющей ширину в несколько километров, до Казани. Вероятно, сера образовалась в лагунах в пермский период в результате биохимических процессов. Месторождения серы находятся в Раздоле (Львовская область, Прикарпатье), Яворовске (Украина) и в Урало-Эмбинском районе. На Урале (Челябинская обл.) встречается сера, образовавшаяся в результате окисления пирита. Сера вулканического происхождения имеется на Камчатке и Курильских островах. Основные запасы находятся в Ираке, США (штаты Луизиана и Юта), Мексике, Чили, Японии и Италии (о. Сицилия).
Роль серы в организме человека
В организме человека содержится 140 г этого макроэлемента. По весу он занимает 8-ое место. Из нутриентов уступает лишь кальцию и фосфору.
Сера есть во всех клетках. Больше всего ее в костях и волосах, немного меньше – в суставах, сухожилиях, ногтях и коже. Она входит в состав протеиновых аминокислот, содержится в белках, которые отвечают за эластичность всех тканей. Именно поэтому продукты с серой нужно включать в ежедневный рацион.
Этот макроэлемент участвует в синтезе ряда биологически активных веществ – гормонов, в том числе инсулина, витаминов группы В, цистеина, метионина, липоевой кислоты, антител, коллагена, кератина, коэнзимов и других. Он входит в состав 150 химических соединений.
Польза серы для организма человека:
поддерживает эластичность и упругость тканей;
защищает от радиационного облучения и негативного воздействия окружающей среды;
участвует в обновлении клеток, поэтому способствует процессам омоложения;
отвечает за ионный обмен, поддерживает нормальный калиево-натриевый баланс, что важно для уничтожения токсинов;
обладает противоаллергическим действием;
поддерживает здоровье суставов, хрящей, костей;
ускоряет рост волос и ногтей;
регулирует секрецию желчного пузыря;
усиливает защитные силы организма, поскольку участвует в выработке антител;
нормализует работу желез внутренней секреции;
улучшает пищеварение за счет производства ферментов;
обладает противовоспалительным действием, увеличивает активность кортизола;
является природным анальгетиком, поскольку блокирует передачу болевых импульсов через нервные волокна;
регулирует уровень сахара в крови;
улучшает клеточное дыхание;
участвует в процессе свертывания крови;
обладает противопаразитарным действием.
Макроэлемент регулирует процессы жизнедеятельности, поддерживает нормальное состояние волос и кожи. В совокупности с другими витаминами и минералами способен подарить красоту, молодость кожному покрову и суставам.
В медицине серу применяют для лечения кожных заболевания (прыщей, угрей, экземы, чесотки, фурункулеза). Она улучшает самочувствие при сахарном диабете, аллергии, астме, болезнях костей и суставов, при заболеваниях нервной системы, отравлениях.
При участии серы усиливается выработка слизи, покрывающей стенки дыхательных путей. Благодаря этому бронхи и легкие защищены от воздействия патогенных микроорганизмов. Особенно выражены полезные свойства макроэлемента для органов дыхания при бронхиальной астме.
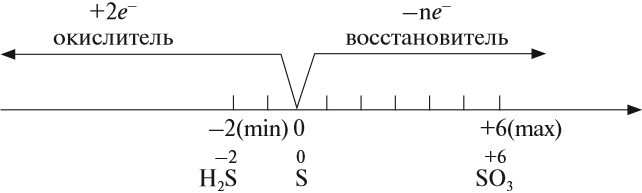
Строение атома и свойства серы
Сера — элемент шестой группы третьего периода периодической системы Менделеева. Поэтому строение атома серы изображается так:
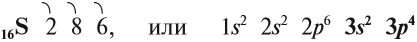
Строение атома серы указывает на то, что это неметалл, т. е. атом серы способен и к приёму электронов и к отдаче электронов:
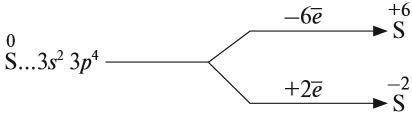
Задание 15.1. Составить формулы соединений серы, содержащие атомы серы с данными степенями окисления.
Простое вещество «сера» — твёрдый хрупкий минерал жёлтого цвета, нерастворимый в воде. В природе встречается как самородная сера, так и её соединения: сульфиды, сульфаты. Сера как активный неметалл легко реагирует с водородом, кислородом, почти со всеми металлами и неметаллами:
Задание 15.2. Назовите полученные соединения. Определите, какие свойства (окислителя или восстановителя) проявляет сера в этих реакциях.
Как типичный неметалл простое вещество сера может быть и окислителем, и восстановителем:
Иногда эти свойства проявляются в одной реакции:
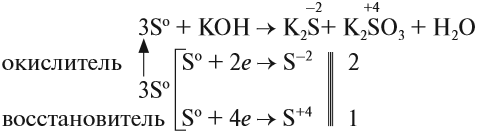
Поскольку атом-окислитель и атом-восстановитель одинаковые, их можно «сложить», т. е. на оба процесса нужно три атома серы.
Задание 15.3. Расставьте остальные коэффициенты в этом уравнении.
Сера может реагировать с кислотами — сильными окислителями:
Таким образом, являясь активным неметаллом, сера образует множество соединений. Рассмотрим свойства сероводорода, оксидов серы и их производных.
Нахождение в природе
Сера встречается в земной коре с долей 0,048% (15-й элемент по частоте распространения). Огромные месторождения расположены в Сицилии, Польше, Ираке, Иране, Луизиане, Техасе и Мексике.
Распространена сера в сульфидных минералах, таких как пирит (FeS2), халькопирит (CuFeS2), галенит (PbS) и сфалерит (ZnS). Большинство металлов (особенно тяжелых металлов) встречаются в природе в виде плохо растворимых сульфидов.
Важным источником серы являются ископаемые виды топлива, такие как нефть, природный газ и уголь. В частности, природный газ содержит относительно большое количество сероводорода (H2S).
Важными минералами, содержащими соединения серы, являются гипс (сульфат кальция), пирит и марказит (сульфид железа), цветной гравий меди (сульфид меди), галенит (сульфид свинца), цинковая обманка (сульфид цинка) или киноварь (сульфид ртути). Большие количества серы также содержатся в ископаемом топливе, нефти и угле. Природный газ часто загрязнен сероводородом.
Распространение Серы в природе

Сера относится к весьма распространенным химическим элементам (кларк 4,7·10-2); встречается в свободном состоянии (самородная сера) и в виде соединений — сульфидов, полисульфидов, сульфатов. Вода морей и океанов содержит сульфаты натрия, магния, кальция. Известно более 200 минералов Серы, образующихся при эндогенных процессах.
В биосфере образуется свыше 150 минералов Сера (преимущественно сульфатов); широко распространены процессы окисления сульфидов до сульфатов, которые в свою очередь восстанавливаются до вторичного H2S и сульфидов. Эти реакции происходят при участии микроорганизмов.
Многие процессы биосферы приводят к концентрации Серы — она накапливается в гумусе почв, углях, нефти, морях и океанах (8,9·10-2%), подземных водах, в озерах и солончаках. В глинах и сланцах Серы в 6 раз больше, чем в земной коре в целом, в гипсе — в 200 раз, в подземных сульфатных водах — в десятки раз.
В биосфере происходит круговорот Серы: она приносится на материки с атмосферными осадками и возвращается в океан со стоком. Источником Сера в геологическом прошлом Земли служили главным образом продукты извержения вулканов, содержащие SO2 и H2S. Хозяйственная деятельность человека ускорила миграцию Серы; интенсифицировалось окисление сульфидов.
Избыток серы
Передозировка серой в случае употребления продуктов питания маловероятна и медицинскими специалистами практически нигде не описана. Иногда встречаются факты избыточного скопления внутри серы в следствие злоупотребления сульфитами, т.е. серосодержащие вещества, которых большое количество в пиве и других алкогольных напитках, копченостях, уксусе, некоторых свежих овощах (картофель и др.).
Особенно тяжело протекают отравления летучими серосодержащими веществами — сероводородом, серным ангидридом, сернистым газом и прочими.
Отравление серой сопровождается следующими симптомами:
- Со стороны кожного покрова – кожный зуд, появление крапивницы и других видов сыпи, развитие фурункулеза;
- Со стороны нервной системы – головные боли, головокружения, судороги, ухудшение мыслительной функции, психозы, в плоть до потери сознания (при остром отравлении);
- Со стороны органов зрения – покраснение глаз, светобоязнь, боль в глазах, развитие конъюнктивита, чувство инородных предметов в глазах, повышенное слезотечение, повреждение роговицы;
- Со стороны ЖКТ – тошнота, диарея, снижение аппетита;
- Общие – снижение массы тела, слабость, ухудшение слуховой функции, анемия.
В случае вдыхания сероводорода в течение нескольких минут у человека появляются признаки удушья и потеря сознания, судороги и паралич, вплоть до остановки дыхания.
При тяжелых поражениях серой человек может умереть.
Причины переизбытка S в организме
- Злоупотребление препаратами, в которых содержится это вещество;
- Нарушение метаболизма серы;
- Пренебрежение правилами безопасности при работе с летучими серными веществами – отсутствие приспособлений индивидуальной защиты (респираторов, масок и прочих).
Историческая справка

Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времен. Она упоминается в Библии, поэмах Гомера и других. Сера входила в состав «священных» курений при религиозных обрядах; считалось, что запах горящей Серы отгоняет злых духов.
Сера давно стала необходимым компонентом зажигательных смесей для военных целей, например «греческого огня» (10 в. н. э.). Около 8 века в Китае стали использовать Серу в пиротехнических целях. Издавна Серой и ее соединениями лечили кожные заболевания.
В период арабской алхимии возникла гипотеза, согласно которой Сера (начало горючести) и ртуть (начало металличности) считали составными частями всех металлов.
Элементарную природу Серы установил А. Л. Лавуазье и включил ее в список неметаллических простых тел (1789). В 1822 году Э. Мичерлих обнаружил аллотропию Серы.
Роль и значение серы в организме человека
По степени распространённости в природе соединения серы занимают 16-е место, в организме содержится около 0,25% минерала. Как и кислород, она располагается в VI группе таблицы Менделеева, что обуславливает схожесть их окислительно-восстановительных свойств и высокую химическую активность.
В организме сера содержится в виде различных соединений, большое количество минерала наблюдается в крови, костной, хрящевой ткани, тканях печени, нервных узлах.
В организме соединения серы выполняют следующие функции:
- Связь между атомами серы стабилизирует структуру белка на молекулярном уровне – дисульфидный мостик.
- Входит в состав инсулина, служит для нормализации уровня глюкозы в крови. Является составной частью различных ферментов, участвующих во всех биохимических реакциях.
- Поскольку данный химический элемент входит в состав меланина, коллагена и кератина, его прозвали «минералом красоты». Перечисленные вещества благотворно влияют на состояние кожных покровов, волосяных луковиц и ногтей.
- Является энергетическим транспортом клетки, поскольку может переносить электроны кислорода и метильные группы. Обеспечивает защиту тканей и клеток от окислительных процессов.
- Входит в состав витаминов группы B – биотина, тиамина, пантотеновой и липоевой кислоты. Перечисленные вещества отвечают за нормальное функционирование пищеварительной, нервной, эндокринной систем.
- Соединения серы – мощные антиоксиданты. Они защищают организм от вредного влияния извне: свободных радикалов, аллергенов, токсинов, радионуклидов, вредных химических соединений. Мази на основе минерала используют для лечения кожных заболеваний, аллергической сыпи.
- Стимулирует процесс выделения желчи, необходимой для расщепления жиров.
- Серосодержащий белок коллаген отвечает за рост соединительной ткани, укрепляет мышцы и кости, нормализует работу суставов, связок. Коллаген обеспечивает нормальную работу сердечных клапанов.
- Является составной частью незаменимой аминокислоты метионина. Она оказывает гепатопротекторное воздействие, снижает уровень холестерина в крови, уменьшает воспаления, способствует быстрому заживлению раневой поверхности.
- Отвечает за передачу генетической информации, тканевое дыхание.
- Входит в состав гепарина, препятствующего свёртываемости крови.
Метаболизм серы в организме плохо изучен, но специалисты отмечают, что усвоение минерала регулируется теми, же гормонами, что отвечают за белковый обмен – гормоны гипофиза, половых желёз, надпочечников, щитовидной и паращитовидных желёз.
Основным источником поступления нутриента в организм являются белки и аминокислоты. Неорганические соли серы покидают человеческий организм в неизменном виде вместе со стулом, частично они всасываются после восстановления до сульфида серы. Органические соединения белковой природы расщепляются и усваиваются стенками кишечника. Они выводятся с мочой (около 60%) в форме сульфатов и сульфитов, сложных эфиров, нейтральной серы. Также путём выведения являются лёгкие, кожные покровы и потовые железы, отчего пот и приобретает неприятный запах.
Получение
В 1936-40 годах было освоено получение и производство коллоидной серы, которую получали в качестве побочного продукта при очистке коксовых газов от сероводорода. После отмывки от солей роданистоводородной кислоты и фитоцидных соединений мышьяка серу начали использовать в качестве активного акарицида и фунгицида для борьбы с мучнистой росой огурцов.
В послевоенный период на Роздольском горно-химическом комбинате было начато крупное промышленное производство смачивающегося порошка серы.
Для получения порошка тонкого помола вещество размалывают на специальных мельницах-микронизаторах. Часто используют осажденную коллоидную серу (выделяемую при очистке коксовых и других газов, содержащих сероводород), которую отмывают водой от фитоцидных примесей, добавляют диспергатор (обычно сульфитный щелок) и подсушивают. В некоторых странах для нужд сельского хозяйства серу получают осаждением из водных растворов тиосульфата натрия (гипосульфита). Концентрированный раствор тиосульфата аккуратно подкисляют серной кислотой, выделившаяся сера подвергается очистке диализом от растворимых в воде солей. Это один из способов получения коллоидной серы высокой дисперсности, которая не осаждается из суспензии на протяжении многих месяцев.