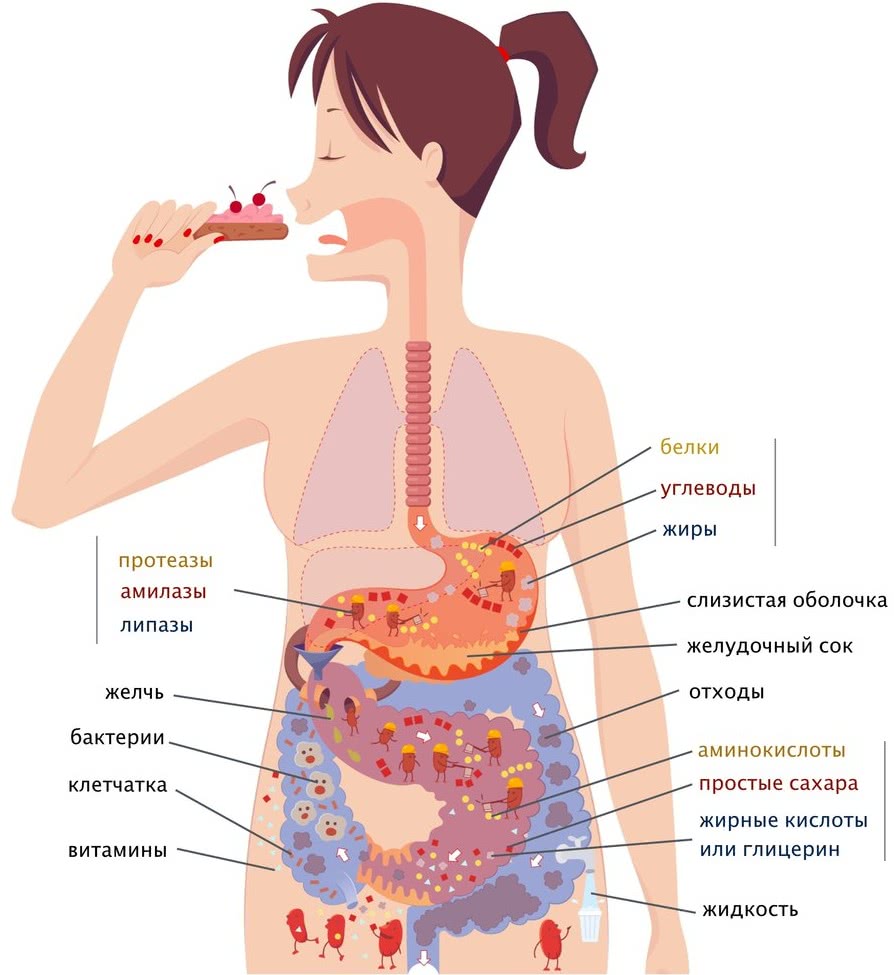
Нехватка фосфора — симптомы
Дефицит фосфора в организме (гипофосфатемия) дает о себе знать, когда его количество в сыворотке крови составляет 0,81-0,32 ммоль/л и меньше. Это может вызвать ряд осложнений со здоровьем, среди которых:
- Постоянная усталость, быстрая утомляемость, вялость;
- Повышенная раздражительность, чувство тревоги;
- Нарушение дыхательной функции;
- Скованность в движении, нарушения координации, боль в суставах;
- Головокружения, «туманность» сознания;
- Отсутствие аппетита, колебания веса;
- Повышенная восприимчивость к простудным заболевания и другим ОРЗ;
- Замедление роста ребенка, а также нарушения в формировании костно-мышечного скелета и зубов в детском организме.
Причины нехватки фосфора
- Нарушения усвояемости Р организмом, что обычно связано с – гиповитаминоз D, длительные жесткие диеты и голодания, алкоголизм, мальабсорбция;
- Повышенное выведение Р из организма, причиной чего могут стать – заболевания почек, гиповитаминоз D, гиперфункция паращитовидных желез, увеличенный объем внутриклеточной жидкости, прием некоторых лекарственных препаратов (мочегонных и кортикостероидов).
- Избыток в организме – алюминия (Al), кальция (Са) и магния (Mg), железа (Fe), эстрогенов, андрогенов и тироксина;
- Другие причины – стремительный рост костной ткани у детей в период развития, недостаток Р в пище, наличие хронических болезней почек, щитовидных и паращитовидных желез.
Продукты питания, содеРжащие фосфор
Фосфор – легкоусвояемый микроэлемент. 75 % соединения, поступающего с едой, вовлекается в обмен веществ.
При этом, микроэлемент, содержащийся в морепродуктах, рыбе, всасывается на 99%, в злаковых и бобовых – на 20%, фруктах, соках – на 10%. Как видно, фосфор из растительных продуктов сложно усваивается организмом. Это связано с тем, что он образует фитиновые соединения и не высвобождается.
Основные источники фосфора – животные продукты (творог, сыр, рыба, яичный желток, мясо). Соединения микроэлемента из зерновых и бобовых культур плохо усваиваются в организме человека, по причине отсутствия фермента в кишечнике, расщепляющего их.
| Наименование продукта | Содержание фосфора в 100 граммах, миллиграмм |
|---|---|
| Сушеные подберезовики | 1750 |
| Дрожжи сухие | 1290 |
| Семена тыквы | 1233 |
| Отруби пшеничные | 1200 |
| Запеченная тыква | 1172 |
| Зародыши пшеницы | 1100 |
| Мак | 900 |
| Цельное сухое молоко | 790 |
| Соевые бобы | 700 |
| Подсолнечник | 660 |
| Какао порошок | 650 |
| Кунжут | 629 |
| Плавленый сыр | 600 |
| Кешью | 593 |
| Икра осетровая | 590 |
| Кедровый орех | 572 |
| Грецкий орех | 558 |
| Сыр Российский, Голландский | 539 |
| Овес | 521 |
| Фасоль | 500 |
| Фисташки | 490 |
| Яичный желток | 485 |
| Миндаль | 483 |
| Гречиха | 422 |
| Камбала | 400 |
| Брынза | 375 |
| Печень свиная | 347 |
| Рис | 323 |
| Печень говяжья | 314 |
| Сардина | 280 |
| Тунец | 280 |
| Скумбрия | 280 |
| Осетр | 270 |
| Краб | 260 |
| Ставрида | 250 |
| Кальмар | 250 |
| Мойва | 240 |
| Минтай | 240 |
| Креветки | 225 |
| Творог | 220 |
| Фундук | 220 |
| Треска | 210 |
| Баранина | 202 |
| Колбаса докторская | 178 |
| Яйца | 170 |
| Зеленый горошек | 157 |
| Курица | 157 |
| Чеснок | 152 |
| Фасоль | 146 |
| Кефир | 143 |
| Изюм | 114 |
| Йогурт | 94 |
| Молоко | 92 |
| Брокколи | 65 |
| Шпинат | 50 |
| Цветная капуста | 43 |
| Свекла | 40 |
| Зеленая фасоль | 37 |
| Киви | 34 |
| Помидоры | 30 |
| Морковь | 24 |
| Баклажаны | 24 |
| Сельдерей | 23 |
| Бананы | 22 |
| Слива | 16 |
| Клюква | 14 |
| Яблоки | 11 |
Обогащая рацион продуктами, содержащими фосфор, помните, что допустимая норма микроэлемента в крови для новорожденных составляет 1,19 – 2,78 миллимоль на литр, для взрослых людей – 0,81 – 1,45. Снижение концентрации приводит к развитию гипофосфатемии, повышение – гиперфосфатемии. Поэтому питание должно быть сбалансированным, подбирайте меню так, чтобы исключить вероятность нехватки и передозировки незаменимого микроэлемента.
Помните, соединения фосфора очень важны для сохранения здоровья. Они участвуют в энергообмене, построении ферментов (фосфатаз), нормальнойдеятельности почек, сердца, мозга, развитии и сохранении здоровья зубов и костной ткани. В настоящее время учеными доказано, что микроэлемент благоприятно воздействует на либидо.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Автор статьи:
Тедеева Мадина Елкановна
Специальность: терапевт, врач-рентгенолог, диетолог.
Общий стаж: 20 лет.
Место работы: ООО “СЛ Медикал Груп” г. Майкоп.
Образование: 1990-1996, Северо-Осетинская государственная медицинская академия.
Другие статьи автора
Будем признательны, если воспользуетесь кнопочками:
Аллотропные формы
Фосфор (Р) является неметаллом, существует в 11 аллотропных модификациях, различающихся между собой по цвету, плотности, химическим свойствам. Главными из них являются 4:
- зеленовато-белый (желтый);
- красный;
- черный;
- металлический.
Остальные формы пока до конца не изучены, но считается, что они представляют собой смеси из четырех главных. Основные модификации также могут переходить друг в друга, так как являются неустойчивыми. Например, белый фосфор под действием света превращается в красный, тот, в свою очередь, в черный, а потом в металлический. Последняя форма является устойчивой, но с каждым превращением снижается химическая активность вещества.
Где содержится phosporus
Основными источниками служат продукты животного происхождения: творог, мясо, яичный желток. Также присутствует и в зерновых, бобовых культурах, тыкве (мякоть и семена), кунжуте, фисташках, кедровых орехах, но человеку сложно его усвоить, так как в кишечнике нет нужного фермента для расщепления фитиновых соединений, в виде которых макроэлемент поступает из растительной пищи.

Поэтому усваивается не более 20%. Наиболее высокая усвояемость P характерна для морепродуктов, в этом случае всасывается 99%. Если вы испытываете дефицит фосфора, дополните рацион рыбой семейства тресковых или лососевых, скумбрия и карп тоже подойдут.
Соединения фосфора, биологическая роль
Типичные соединения фосфора можно представить в виде таблицы:
Соединения фосфора являются неотъемлемым компонентом растительных и животных организмов. Растения формируют запасы данного вещества в семенах и плодах. В организме человека и животных фосфор содержится в тканях скелета, мышц и нервной системы. По усредненным показателям человеческое тело содержит примерно 1,5 кг фосфора:
- из общего объема доля в 1,4 кг находится в костях;
- 130 г вещества приходится на мышцы;
- 12 г фосфора содержит нервная ткань.
У людей во взрослом возрасте около 86% фосфора находится в минеральной части костей и зубов. Оставшийся объем вещества распределен по мышцам, органам, жидкостям организма. Большой концентрацией фосфора обладают ткани нервных клеток и мозга.
Биологическое значение фосфора:
- Фосфор обеспечивает нормальное формирование костной и зубной тканей. В дальнейшем фосфор поддерживает их целостность на протяжении всей жизни человека.
- Входит в состав нуклеиновых кислот, в том числе, ДНК, РНК, молекул, которые хранят и передают наследственную информацию, отвечают за нормальное деление и рост клеток.
- Фосфор, являясь компонентом ферментов, участвует в жировом обмене, синтезе и распаде гликогена и крахмала.
- Как составная часть фосфорной кислоты и фосфатов, фосфор принимает участие в мыслительных процессах, движении, дыхании, обеспечивает нормальный белковый и углеводный обмен.
- Энергетическое питание каждого из процессов жизнедеятельности в составе АТФ.
- Совместно с белками и жирными кислотами фосфор формирует высокоактивные соединения. В качестве примера можно привести лецитин, который необходим для образования клеточных и мозговых оболочек. Большой объем лецитина организм потребляет в процессе физических и психоэмоциональных нагрузок. По этой причине недостаток фосфора снижает защиту клеток.
- Соединения фосфора необходимы, чтобы поддерживать кислотно-щелочное равновесие в организме. Это обусловлено их присутствием в составе крови и других жидкостей. С помощью фосфора формируются активные формы витаминов, так как фосфорсодержащие вещества запускают необходимые для этого ферментные реакции.
- Соединяясь с азотом, жирными кислотами и глицерином, фосфор образует фосфолипиды, которые принимают участие в каждом физиологическом процессе организма.
- Фосфорсодержащие вещества повышают кислотность мочи и снижают вероятность образования камней в почках.
Пентафторид фосфора
PF5 – бесцветный газ. В соединении фосфор проявляет степень окисления 5, являющуюся самой характерной для элемента. Кипит вещество без разложения, но процесс может начаться при дальнейшем нагревании. Водой оно гидролизуется, вступает в реакции со щелочами, фтороводородом, диоксидом кремния. Образует фторокомплексы.

Способы его получения следующие:
- быстрое разложение красного фосфора при температуре минус 60 градусов со фтором в избытке аргона в качестве катализатора;
- взаимодействие пентахлорида фосфора с фторидом кальция при 300-400 градусах либо с жидким фторидом мышьяка при комнатной температуре.
Полученное соединение применяют в производстве фторофосфатов, а также в качестве ингибитора коррозии металлов.
Таким образом, фосфор и его соединения имеют большое значение в промышленности и применяются в различных отраслях.
Нахождение в природе, получение:
Фосфор — один из самых распространённых элементов земной коры, его содержание составляет 0,08-0,09 % её массы. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3F, фосфорит Ca3(PO4)2 и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ), является элементом жизни.
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и песком при температуре 1500°С:
2Ca3(PO4)2 + 10C + 6SiO2 = 4P + 10CO + 6CaSiO3
Образующиеся пары белого фосфора конденсируются в приёмнике под водой. Вместо фосфоритов восстановлению можно подвергнуть и другие соединения, например, метафосфорную кислоту:
4HPO3 + 12C = 4P + 2H2 + 12CO
Как выявить нехватку фосфата
Жидкий фосфор, в виде удобрения должен использоваться для предотвращения дефицита этого элемента. Легкий или умеренный дефицит фосфора трудно распознать. Рост растения может быть медленнее, чем у здоровых растений, без появления идентифицируемых симптомов дефицита фосфора. Легкий дефицит часто ассоциируется с более темным, чем обычно, голубовато-зеленым цветом листвы.
В отличие от дефицита азота, молодые листья остаются темно-зелеными на всех уровнях развития. Первым признаком нехватки фосфора является преждевременное старение листьев. В большинстве сортах пожелтение предшествует появление фиолетовых антоцианиновых пигментов, вызывающих ряд оттенков желтого в листьях.
Некротические поражения могут развиваться в хлоротических зонах, а некрозы распространяются пятна до тех пор, пока листовая пластинка не станет полностью коричневой и сухой. В некоторых сортах желтизна предшествует некротическим повреждениям, которые появляются на зеленой ткани листка. Некоторые сорта могут обрести фиолетовую пигментацию на поверхности молодых листьев.

https://youtube.com/watch?v=8mhm-n1D49A
https://youtube.com/watch?v=7c-FEUXC-9Y
Красный фосфор
Такая модификация состоит из полимерных молекул Рn разных размеров. Она метастабильна и рентгеноаморфна, возгоняется при нагревании. Ее химическая активность слабая. Как и белый фосфор, эта форма окисляется на воздухе, но процесс идет значительно медленнее и самовоспламенения не наблюдается, пока температура не достигнет 240 градусов, или вещество не подвергнется трению. В присутствии влаги красная форма превращается в оксид, а затем в фосфорную кислоту. Из-за этого ее хранят в герметичной таре, но если преобразование все же произошло, промывают водой от остатков химических соединений фосфора и высушивают.
Сероуглерод, как и вода, не способен растворить красную модификацию, зато это может сделать трибромид фосфора, а также расплав висмута или свинца, из которого впоследствии выкристаллизовывается фиолетовая форма Р8.
Красный фосфор получают нагреванием белого в атмосфере угарного газа при температуре 500 градусов Цельсия. В зависимости от степени дробления может иметь вариации цвета от пурпурно-красного до темно-фиолетового с металлическим блеском. Процесс может идти и в обратную сторону: если перевести красную модификацию в пар, то остыв, она превратится в белую.
Применение у красного фосфора и его соединений широкое. В первую очередь, это обусловлено тем, что они существенно менее ядовиты, чем у белой формы. Они используются в производстве спичек, так как загораются от трения.

Зачем нужен и польза
Фосфор играет важную роль в структуре костей, входя в состав минерала под названием гидроксиапатит. Фосфолипиды являются основой клеточных мембран. Вся энергия, производимая клетками, хранится в соединениях фосфора, в первую очередь — АТФ. ДНК и РНК, в которых хранится наследственная информация — длинные цепочки молекул, содержащих фосфор. Многочисленные ферменты, гормоны и сигнальные молекулы зависят от фосфора. Также он помогает поддерживать кислотно-щелочной баланс организма. Наконец, фосфорсодержащие соединения регулируют доставку кислорода в ткани гемоглобином.
История открытия
В 1669 гамбургский купец и по совместительству алхимик Хенниг Брандт в очередной раз пытался осуществить мечту всех средневековых алхимиков – найти легендарный философский камень, якобы превращающий все металлы в золото и дарующий бессмертие
Увы, философский камень и в этот раз найти не удалось, но, тем не менее, Хеннигу посчастливилось сделать другое не менее важное открытие в химии. На этот раз в качестве эксперимента немецкий алхимик решил выпаривать воду из… человеческой мочи
В результате череды сложных химических манипуляций над собственной мочой в реторте у алхимика образовалось неведомое до того светящееся вещество – фосфор.
К слову, само слово «фосфор» с древнегреческого переводится как «несущий свет». Именно такое название он получил за свою удивительную способность светиться в темноте. Первооткрыватель фосфора алхимик Хенниг Брандт быстро понял свою выгоду от этого открытия и за большие деньги показывал светящийся фосфор разным знатным и богатым господам, нажив при этом большое состояние (развлечений в то время в Европе было не так уж и много, так что научно-популярные представления предприимчивого алхимика пользовались большим спросом).

Впрочем, Хенинг Брандт был не первым, кто добыл фосфор опытным путем. Еще до него, в XII веке это удалось сделать арабскому алхимику Алхиду Бехилу, все также благодаря химическим манипуляциям с мочой и глиной, но его открытие затерялось, и именно повторное открытие фосфора немецким алхимиком принесло широкую популярность этому химическому элементу.
Первое время после открытия фосфор вызывал лишь любопытство своим свечением и только в конце XIX века ученые поняли, что фосфор также является чрезвычайно важным полезным микроэлементом для жизнедеятельности человеческого организма.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 + 3H2O → 2H3PO4
2. Еще одинспособ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) + 3H2SO4(конц) → 2H3PO4 + 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Фосфорные удобрения
Смесь Са(Н2Р04)2 и CaS04 называется простым суперфосфатом, Са(Н2Р04)2 с примесью СаНР04 — двойным суперфосфатом, они легко усваиваются растениями при подкормке.
Наиболее ценные удобрения — аммофосы (содержат азот и фосфор), представляют собой смесь аммонийных кислых солей NH4H2PO4 и (NH4)2HPO4.
Хлорид фосфора (V) PCI5. Бинарное соединение. Белый, летучий, термически неустойчивый. Молекула имеет строение тригональной бипирамиды (sp3 d-гибридизация). В твердом состоянии димер P2Cl10 с ионным строением РСl4+[РСl6]—. «Дымит» во влажном воздухе. Весьма реакционноспособный, полностью гидролизуется водой, реагирует со щелочами. Восстанавливается белым фосфором. Применяется как хлорагент в органическом синтезе. Ядовит.
Уравнения важнейших реакций:
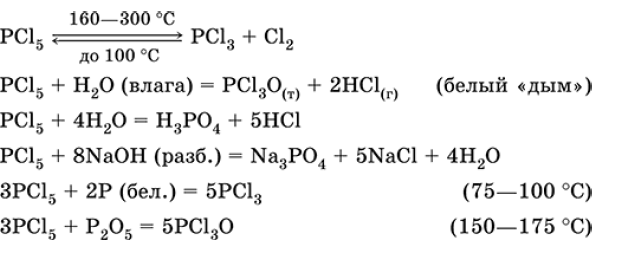
Получение: хлорирование фосфора.
Галогены
В VIIА группе находятся фтор, хлор, бром, йод и астат. Эти элементы называют также галогенами (в переводе — рождающие соли).
На внешнем энергетическом уровне всех этих элементов находятся 7 электронов (конфигурации ns2np5), наиболее характерные степени окисления –1, +1, +5 и +7 (кроме фтора).
Атомы всех галогенов образуют простые вещества состава Hal2.
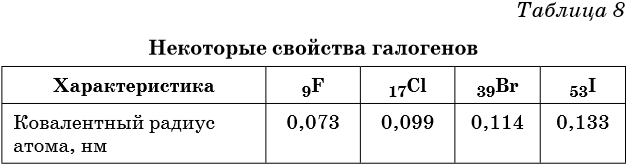
Галогены являются типичными неметаллами. При переходе от фтора к астату происходит увеличение радиуса атома, неметаллические свойства падают, происходит уменьшение окислительных и увеличение восстановительных свойств.
Физические свойства галогенов приведены в таблице 8.

В химическом отношении галогены весьма активны. Их реакционная способность убывает с увеличением порядкового номера. Некоторые характерные для них реакции приведены ниже на примере хлора:
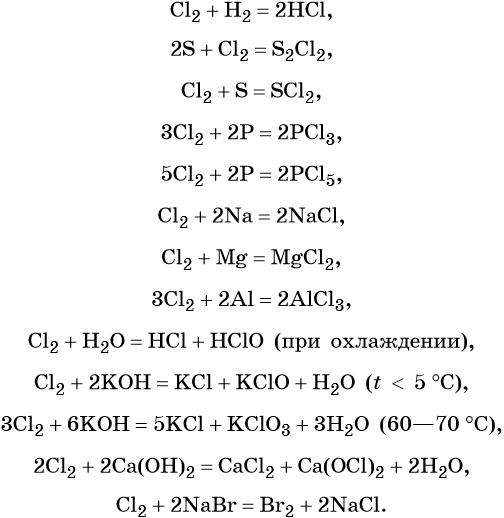
Водородные соединения галогенов — галогеноводороды имеют общую формулу HHal. Их водные растворы являются кислотами, сила которых возрастает от HF к HI.
Галогенводородные кислоты (за исключением HF) способны реагировать с такими сильными окислителями, как KMnO4, MnO2, K2Cr2O7, CrO3 и другими, с образованием галогенов:
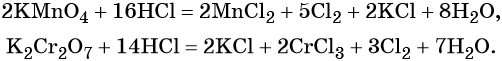
Галогены образуют ряд оксидов, например, для хлора известны кислотные оксиды состава Cl2O, ClO2, ClO3, Cl2O7. Все эти соединения получают косвенными методами. Они являются сильными окислителями и взрывоопасными веществами.
Наиболее устойчивым из оксидов хлора является Cl2O7. Оксиды хлора легко реагируют с водой, образуя кислородсодержащие кислоты: хлорноватистую HClO, хлористую HClO2, хлорноватую HClO3 и хлорную HClO4, например:
В промышленности бром получают при вытеснении хлором из бромидов, а в лабораторной практике — окислением бромидов:
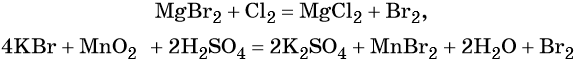
Простое вещество бром является сильным окислителем, легко вступает в реакции со многими простыми веществами, образуя бромиды; вытесняет йод из йодидов.
Простое вещество йод, I2, представляет собой чёрные с металлическим блеском кристаллы, которые возгоняются, т. е. переходят в пар, минуя жидкое состояние. Йод мало растворим в воде, но довольно хорошо растворяется в некоторых органических растворителях (спирт, бензол и т. д.).
Йод является довольно сильным окислителем, способным к окислению ряда металлов и некоторых неметаллов.
Где содержится и почему об этом полезно знать
Макроэлемент является одним из важнейших участников в формировании различных тканей, на его долю в нашем теле приходится 1 % веса (у взрослых людей насчитывается в среднем 500-700 грамм). Наибольшая его концентрация характерна для зубов и костей. Но присутствует практически повсеместно — в мышцах, сухожилиях, сосудах, нервах, жировой клетчатке, плазме крови.
Фосфор (Р) входит в различные соединения, выполняющие различные функции. Например, фосфолипиды (состоят из фосфорной кислоты, многоатомных спиртов и жирных кислот) участвуют в строительстве клеточной оболочки. Именно эти элементы способны восстанавливать поврежденные участки кожи, печени, мозга и других органов. Если данных липидов недостаточно, то существенно замедляются регенерационные процессы, нарушается межклеточный метаболизм.
Phosporus соединяется также с белками и другими макроэлементами. С его участием образуются протеины, ферменты, нуклеиновые кислоты и другие вещества, необходимые для нормальной жизнедеятельности. Уровень P напрямую влияет на усвояемость кальция, что определяет состояние костей и зубов. Баланс химических элементов — очень важен для здоровья, скорости метаболизма и качества жизни.
Для каких процессов необходим мониторинг фосфора?
Питьевая вода
В заборной воде может быть высокая концентрация фосфатов от сельскохозяйственных сточных вод, что может привести к эвтрофикации поверхностных вод с ростом водорослей и выделением цианотоксинов. Конденсированные фосфаты часто используются для контроля за коррозией в системах распределения питьевой воды, поэтому для процессов очистки питьевой воды может потребоваться мониторинг фосфатов как в исходной, так и в распределяемой очищенной воде.

Очистка сточных вод
Фосфор — это естественный нутриент для растений и, особенно, водорослей. Попадание фосфора вместе с другими естественными биогенными элементами в очищенные сточные воды стимулирует рост водорослей в потоках, в которые осуществляется слив
Водоросли портят вкус, запах и эстетические свойства, и, что самое важное, они создают огромную потребность в кислороде, когда отмирают их цветки. Истощение кислорода, вызванное отмирающими цветками водорослей, является токсичным для рыб и вызывает другие значительные нарушения в водной среде
По этим причинам регулирующие органы часто строго ограничивают количество фосфора, допустимое в сливаемой сточной воде.
Наиболее распространенными методами удаления фосфора из сточных вод являются биологическое удаление и химическое осаждение. Эти процессы обычно называют третичной обработкой, и для них требуется мониторинг фосфора.

Физические свойства
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белый, красный, черный и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропических модификации фосфора, а в условиях сверхвысоких давлений — также металлическая форма. Все модификации различаются по цвету, плотности и другим физическим характеристикам; заметна тенденция к резкому убыванию химической активности при переходе от белого к металлическому фосфору и нарастанию металлических свойств.

Желтый фосфор
Неочищенный белый фосфор называют желтым. Его цвет варьируется от светлого до темно-бурого. Хранить и перевозить вещество можно только под слоем воды или раствора хлорида кальция, так как оно огнеопасно и ядовито, окисляется кислородом воздуха, что приводит к его воспламенению, сопровождающемуся горением ярко-зеленого пламени и выделением густого белого дыма.
Чтобы потушить огонь, нужно очень большое количество ледяной воды, но лучше воспользоваться раствором сульфата меди. Во избежание повторного возгорания уже потушенный очаг нужно дополнительно засыпать влажным песком.
Экспертиза трудоспособности
Заболевания зубов и десен подлежат немедленному лечению с отстранением заболевшего на это время от контакта с Ф. или его токсическими соединениями. Наличие даже нерезко выраженных специфических симптомов хрон. отравления Ф. является абсолютным противопоказанием для дальнейшей работы с ним.
Предельно допустимая концентрация паров и пыли Ф. в воздухе рабочей зоны 0,03 мг/м3, фосфина — 0,1 мг/м3.
Минимально значимая активность препаратов радиоактивного Ф., не требующая регистрации или получения разрешения органов Государственного санитарного надзора, составляет 10 мккюри.
Обзор кислородных соединений
При горении твёрдого фосфора образуется ряд веществ, на состав которых влияет концентрация кислорода в окружающем воздухе. Теоретически существует вероятность ряда метастабильных оксидов с общей формулой P4On, где коэффициент n лежит в интервале от 6 до 9. При диссоциации таких веществ образуются молекулы PO, которые в составе паров обнаруживаются только спектроскопическими методами анализа.
Список номенклатуры соединений, которые индивидуально выделяются, но не имеют широкого практического применения, выглядит так:
- Монооксид тетрафосфора P4O. Образуется при сжигании фосфора в недостатке воздуха или кислорода. Имеет вид красно-бурых кристаллов с плотностью 1,891 грамм/куб. сантиметр, не растворяется в воде. Воспламеняется при 280 °C, при нагревании в атмосфере инертного газа разлагается на P и P2O5.
- Диоксид тетрафосфора P4O2 (P2O) существует в виде димера. Получается продуванием подогретого до 60 °C воздуха или чистого кислорода через раствор легковоспламеняющегося белого фосфора в тетрахлорметане CCl4. Его жёлто-красные кристаллы при атмосферном давлении устойчивы до 100 °C, а в условиях вакуума — до 135 °C. При нагревании разлагается и выделяет P, не растворяется в H2O (воде), C2H5OH (этаноле) и C3H6O (ацетоне), на воздухе окисляется до H3PO3. Высокие восстановительные способности по отношению к ионам Fe3+, Cu2+, Ag+ используются для очистки от примесей железа в экстракционном способе получения H3PO4.
- Октаоксид тетрафосфора P4O8. Образуется при низкотемпературном горении фосфора в ограниченном количестве воздуха как белые хлопья или кристаллы. В газообразном состоянии имеет вид димеров P8O16, в твёрдой фазе присутствуют агрегаты — от мономеров до тримеров. Вещество сохраняет устойчивость при температурах до 100 °C, возгоняется при 180 °C, при нагревании выше 400 °C в чистом кислороде окисляется до P4O10. Кристаллы расплываются на воздухе, хорошо растворяются в воде, но стойки к органическим растворителям. Водные растворы содержат равное количество молей H3PO3 и HPO3 и с трудом окисляются до H3PO4.
- Триоксид (пероксид) фосфора PO3. Некоторые данные сообщают о существовании форм P2O6 или P4O11. Твёрдое вещество имеет фиолетовый цвет, обусловленный примесями. Образуется из паров P4O10 в условиях вакуума при воздействии электрического разряда и сохраняет стабильность до 150 часов при отсутствии влажности и нормальной температуре. Разлагается с выделением O2 при 127 °C, при гидратации даёт пероксофосфорную или пероксопирофосфорную кислоту, вступает в реакции с оксидами многих металлов с образованием солей — пероксофосфатов.
Наиболее устойчивы, даже в парах остаются димерами и имеют для нужд химии практическую ценность Р2О3 — трёхвалентный оксид фосфора и Р2O5 — пятивалентный оксид фосфора. Физические свойства и основные характеристики приведены в таблице:
| Наименование систематическое | Традиционное название | Химическая формула | Молярная масса, грамм/моль | Плотность, грамм/куб. см | Состояние |
| оксид фосфора (III) | фосфористый ангидрид или гексаоксид тетрафосфора | P2O3 | 219,89 | 2,135 | белые хлопья или кристаллы |
| оксид фосфора (V) | фосфорный ангидрид или пентаоксид фосфора | P2O5 | 141,94 | 2.39 | белый порошок |
Биологическая роль
Основную ценность для жизнедеятельности человека представляет фосфорная кислота, которая нужна для обмена жиров, построения ферментов, синтеза и распада углеводов. Совместно с кальцием элемент формирует зубную эмаль, костный скелет.
Польза фосфора: нормализует энергетический обмен; регулирует кислотно-щелочной баланс; укрепляет кости и зубы; снижает болезненные ощущения при артрите; благоприятствует росту организма; содействует делению клеток; улучшает усвоение глюкозы; участвует в кодировании и хранении генетической информации, мышечном сокращении, проведении нервных импульсов.
Креатинфосфат и Аденозинтрифосфорная кислота выступают аккумуляторами энергии, необходимой для жизнедеятельности организма. Снижение количества данных соединений ведет к парализации любого вида деятельности – от умственной до физической.
Витамины A, D, F, соляная кислота, железо, марганец, калий, кальций, белки усиливают усвоение фосфора. Кальциферол, кортикостероиды, тироксин, паратгормон, эстрогены, андрогены, магний и алюминий, совместно с чрезмерным употреблением сахара, наоборот, снижают концентрацию микроэлемента в организме.
Суточная потребность в фосфоре для взрослого человека – 800 миллиграммов. При этом, ежедневно в обычном меню людей присутствует 1200 миллиграммов соединения. Интенсивные занятия спортом, беременность, недостаточное поступление белков вызывают повышенную потребность организма в микроэлементе, которая достигает 1600 – 2000 миллиграммов в день.
Всасывание фосфора зависит от содержания кальция в рационе, идеальное соотношение соединений равняется 1: 1
Дополнительный прием микроэлемента ускоряет вымывание молочной кислоты из мышечной ткани, что особенно важно для спортсменов
Роль фосфора в жизни растений
Этот химический элемент по праву называют источником энергии. Его значение для живых организмов сложно переоценить. Без него зеленое насаждение не сможет стабильно и быстро расти, полноценно развиваться и оказывать сопротивление негативным факторам окружающей среды. Если в грунте будет наблюдаться недостаток этого вещества, посадки в скором времени погибнут.
При достаточном содержании его в почве становится возможным:
- быстрая всхожесть семян;
- рост и развитие всходов;
- лучшая приживаемость высаженных растений;
- формирование мощной подземной части;
- эффективное цветение;
- поднятие иммунных сил у выращиваемых культур.
Свою активность фосфор максимально проявляет на черноземах, где много азота, облегчающего процесс усвоения растительными организмами удобрений на его основе. Здесь будет актуально применять классические варианты фосфорных подкормок. А вот на лесных почвах, где имеется дефицит азота, рекомендовано использование комплексных удобрений.

Признаки недостатка фосфора у растений
Чтобы вовремя отреагировать на развивающуюся деградацию растительных организмов, нужно знать, какие симптомы указывают на фосфорное голодание посадок. Среди явных признаков отмечают:
- Изменение нормальной окраски листьев. На начальной стадии у насаждений надземная часть сначала становится темно-зеленого окраса, а потом багрово-фиолетовой – это уже запущенная форма заболевания.
- Деформация листовых пластин. Они приобретают неправильную форму, края скручиваются.
- Преждевременное опадание листочков.
- Появление некротических изменений, темных образований.
- Рост насаждений приостанавливается, наблюдается развитие кустистости.
- Слабое формирование корневой системы, что приводит к «выпадению» стебля из земли.
При своевременном внесении удобрений, содержащих фосфор, можно избежать подобных проявлений. Но перед тем как использовать агрохимикат, следует выяснить, что могло спровоцировать такой серьезный недостаток.

Причины фосфорного дефицита
Среди негативных факторов, провоцирующих угнетение посадок, садоводы-огородники выделяют:
- Несоблюдение правил использования фосфорно-калийных составов.
- Интенсивная обработка грунта, приводящая к слабому функционированию микрофлоры земли.
- Сосредоточение фосфора в поверхностном слое грунта и превращение его в тяжело усвояемое соединение.
- Невосполнение элемента после уборки выращенных культур.
- Использование агрохимикатов с неправильным составом.
Азот
Химический элемент азот — находится во 2-м периоде, V группе, главной подгруппе периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p3. В своих соединениях азот проявляет степени окисления –3, –2, +1,+2, +3, +4, +5.
Простое вещество азот — газ без цвета и запаха, малорастворимый в воде. Типичный неметалл. В обычных условиях химически мало активен. При нагревании вступает в окислительно-восстановительные реакции.
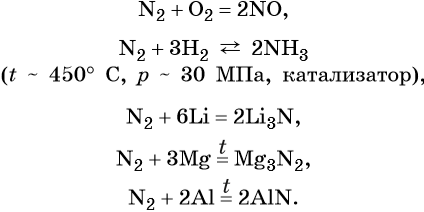
Азот образует оксиды состава N2O, NO, N2O3, NO2, N2O4, N2O5. При этом N2O, NO, являются несолеобразующими оксидами, для которых характерны окислительно-восстановительные реакции; N2O3, NO2, N2O4, N2O5 — солеобразующие кислотные оксиды, для которых также характерны окислительно-восстановительные реакции, в том числе реакции диспропорционирования.
Химические свойства оксидов азота:
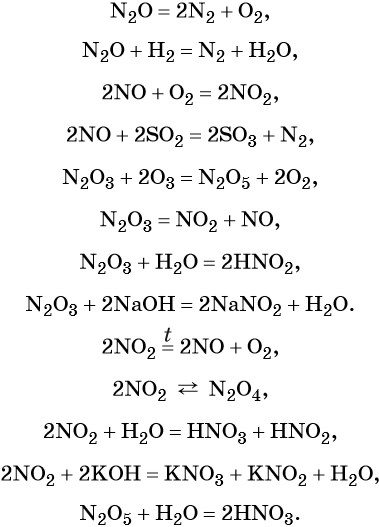
Азот образует летучее водородное соединение состава NH3, аммиак. При обычных условиях это бесцветный газ с характерным резким запахом; температура кипения –33,7 °C, температура плавления –77,8 °C. Аммиак хорошо растворим в воде (700 объёмов NH3 на 1 объём воды при 20 °C) и ряде органических растворителей (спирт, ацетон, хлороформ, бензол).
Химические свойства аммиака:
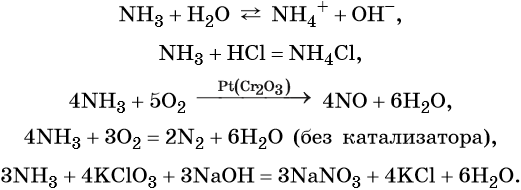
Азот образует азотистую кислоту HNO2 (в свободном виде известна только в газовой фазе или растворах). Это слабая кислота, её соли называют нитритами.
Кроме того, азот образует очень сильную азотную кислоту HNO3. Особенностью азотной кислоты является то, что при её окислительно-восстановительных реакциях с металлами не выделяется водород, а образуются различные оксиды азота или соли аммония, например:
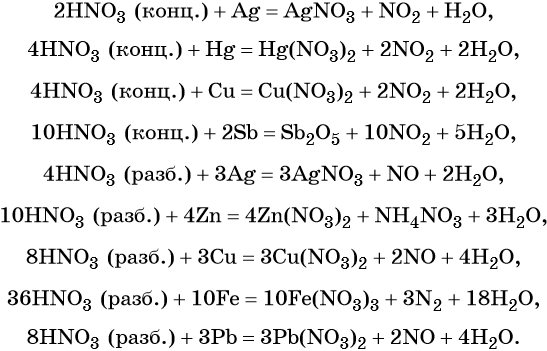
В реакциях с неметаллами концентрированная азотная кислота ведёт себя как сильный окислитель:
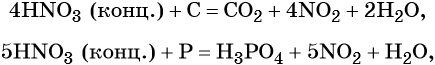
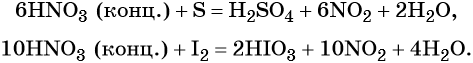
Также азотная кислота способна окислять сульфиды, йодиды и т. д.:
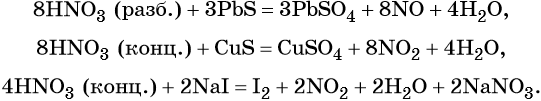
Подчеркнём ещё раз. Запись уравнений окислительно-восстановительных реакций с участием HNO3 обычно условна. Как правило, в них указывают лишь продукт, образующийся в большем количестве. В некоторых из таких реакций в качестве продукта восстановления обнаружен водород (реакция разбавленной HNO3 с Mg и Mn).
Соли азотной кислоты называют нитратами. Все нитраты хорошо растворимы в воде. Нитраты термически нестабильны и при нагревании легко разлагаются.
Особые случаи разложения нитрата аммония:
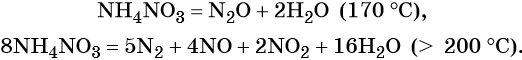
Общие закономерности термического разложения нитратов:
Физические свойства:
Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропных модификаций; вопрос аллотропии фосфора сложен и до конца не решён. Обычно выделяют четыре модификации простого вещества — белую, красную (см. рис.), черную и металлический фосфор. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные являются разновидностью указанных четырёх. В обычных условиях существует только три аллотропных модификации фосфора. Белый фосфор, фосфор в жидком и растворенном состоянии, а также в парах до 800°С состоит из молекул P4. При нагревании выше 800 °С молекулы диссоциируют: P4 = 2P2. При температуре выше 2000°С молекулы распадаются на атомы.Красный фосфор
имеет формулу (Р4)n и представляет собой полимер со сложной структурой, имеет оттенки от пурпурно-красного до фиолетового, растворим в расплавленных металлах (Bi, Pb).Чёрный фосфор
— это наиболее стабильная форма, вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, нерастворимое в воде или органических растворителях, полупроводник.