Физические свойства фтора:
| 400 | Физические свойства | |
| 401 | Плотность* | 0,001696 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ),
1,505 г/см3 (при температуре кипения -188,11 °C и иных стандартных условиях, состояние вещества – жидкость), 1,587 г/см³ (при -218 °C и иных стандартных условиях, состояние вещества – жидкость), 1,81 г/см3 (при -225 °C и иных стандартных условиях, состояние вещества – твердое тело), 1,7 г/см3 (при -228 °C и иных стандартных условиях, состояние вещества – твердое тело), 1,5 г/см3 (при -273 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | -219,67 °C (53,48 K, -363,41 °F) |
| 403 | Температура кипения* | -188,11 °C (85,03 K, -306,60 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 0,5104 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,51 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 31,34 Дж/(K·моль) |
| 411 | Молярный объём | 17,1 см³/моль |
| 412 | Теплопроводность | 0,02591 Вт/(м·К) (при стандартных условиях),
0,028 Вт/(м·К) (при 300 K) |
| 413 | Коэффициент теплового расширения | |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура* | |
| 416 | Критическое давление* | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм.рт.ст.) | |
| 420 | Давление паров (Па) | |
| 421 | Стандартная энтальпия образования ΔH | |
| 422 | Стандартная энергия Гиббса образования ΔG | |
| 423 | Стандартная энтропия вещества S | |
| 424 | Стандартная мольная теплоемкость Cp | |
| 425 | Энтальпия диссоциации ΔHдисс | |
| 426 | Диэлектрическая проницаемость | |
| 427 | Магнитный тип | |
| 428 | Точка Кюри | |
| 429 | Объемная магнитная восприимчивость | |
| 430 | Удельная магнитная восприимчивость | |
| 431 | Молярная магнитная восприимчивость | |
| 432 | Электрический тип | |
| 433 | Электропроводность в твердой фазе | |
| 434 | Удельное электрическое сопротивление | |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое магнитное поле разрушения сверхпроводимости | |
| 437 | Запрещенная зона | |
| 438 | Концентрация носителей заряда | |
| 439 | Твёрдость по Моосу | |
| 440 | Твёрдость по Бринеллю | |
| 441 | Твёрдость по Виккерсу | |
| 442 | Скорость звука | |
| 443 | Поверхностное натяжение | |
| 444 | Динамическая вязкость газов и жидкостей | |
| 445 | Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| 446 | Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| 446 | Предел прочности на растяжение | |
| 447 | Предел текучести | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | |
| 450 | Модуль сдвига | |
| 451 | Объемный модуль упругости | |
| 452 | Коэффициент Пуассона | |
| 453 | Коэффициент преломления |
Биологическая роль фтора
Функции фтора:
- Улучшает состояние зубной эмали, делает ее более прочной, снижает чувствительность зубов, уменьшает риск развитие кариеса
- Укрепляет кости скелета, помогает костям сохранять прочность, улучшает восстановление после переломов, замедляет развитие остеопороза у людей в возрасте
- Принимает участие в образовании эритроцитов
- Участвует в углеводном обмене, регулируя запасание гликогена печенью
- Препятствует накоплению солей тяжелых металлов и радионуклидов в организме, уменьшает вредное воздействие лучевой нагрузки на организм человека
- Взаимодействуя с фосфором и кальцием, усиливает их эффекты в минеральном обмене
- Важен беременным женщинам для полноценной закладки скелета у плода
- Повышает усвоение железа организмом.
Электронное строение
Применение метода МО для молекулы F2 Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
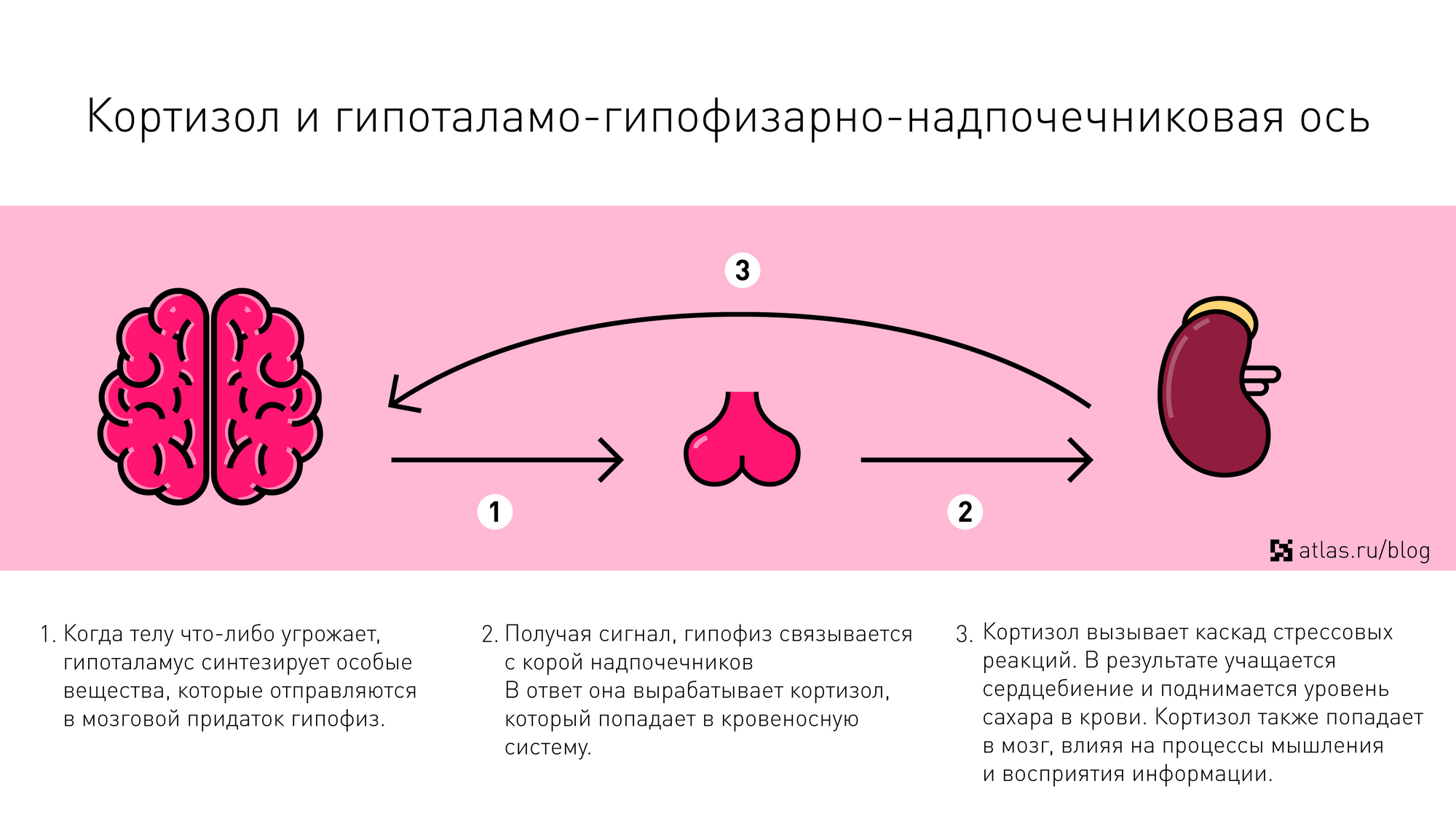
Полезные свойства фтора и его влияние на организм
Организме человека фтор выполняет немало полезных функций. Он отвечает за укрепление иммунитета. Также в Тур участвует в обмене веществ и минерализации костной ткани. Защищает зубную эмаль. Фтор препятствует преждевременному развитию остеопороза, укрепляет костный скелет. Благодаря фтору происходит рост волос и ногтей, он стимулирует кровообращение всего организма.
Фтор не просто так входят в состав многих зубных паст, он помогает защитить зубную эмаль от развития кариеса.Благодаря фтору срастания костей после перелома происходит более быстро. Также данные микроэлемент принимают участие в формировании скелета, И поддерживать его функционирования на протяжении всей жизни. присутствие данного компонента в организме снижают кислотность и бактерий бактерий, мы вызвать проблемы с зубами.
Помогает лучше усваивается железу, он ускоряет процесс выведения из организма радионуклидов и солей тяжёлых металлов. полезные свойства фтора были оценены в медицине. Его соединения входят в состав новых лекарственных препаратов, кровезаменителей, искусственных клапанов сердца.
Источники фторидов
Основным пищевым источником фтора является питьевая вода. С пищевыми продуктами человек может получать только треть всего объема необходимого фтора, остальная часть поступает в организм с водой.
Среди источников фтора также выделяют:
- рыбу (скумбрия, треска, сом);
- субпродукты (печень);
- орехи,
- мясо (баранина, телятина);
- овсяную крупу,
- молоко,
- яйца,
- шпинат и пр.
Несмотря на тот факт, что фториды постоянно поступают в организм с водой и пищей, встречаются случаи, когда можно наблюдать дефицит фтора в организме. Его основными причинами называют нарушение обмена веществ и неверно составленный рацион питания человека.
Последствия дефицита фторидов в организме характеризуются повышенным риском развития кариеса зубов и возникновения явления остеопороза. Для организма также опасно состояние избытка фтора.
Что такое фтор-19?
Химический элемент имеет только один природный изотоп – 19F. Изотопы представляют собой другую форму элемента, отличающуюся по массовому числу, которое соответствует количеству протонов и нейтронов в ядре атома. Количество протонов определяет элемент, но число его нейтронов может быть разным. При этом каждая вариация представляет собой изотоп. У фтора-19 большое гиромагнитное отношение и исключительная чувствительность к магнитным полям. Поскольку это единственный стабильный изотоп, он используется в магнитно-резонансной томографии.
Известны 17 радиоактивных изотопов фтора. Из них наиболее стабильным является 18F. Его ядра делятся с периодом полураспада 109,77 минуты. 18F иногда используется для медицинских исследований. Попадая в организм, фтор перемещается в основном в кости. Его присутствие может быть обнаружено испускаемым им излучением. Радиационная картина позволяет определить состояние костной ткани. Фтор-18 иногда используется аналогично изучению функции мозга.

Польза или вред от фторирования воды?
Фторирование водопроводной воды общего пользования противоречиво, и вызывает возражения, имеющие под собой ряд этических и юридических оснований. Впрочем, как использование зубной пасты с фтором.
С одной стороны, для зубов полезно присутствие фтора, но с другой — его избыточное количество принесет в целом вред организму.
Учреждения здравоохранения и стоматологии по всему миру подтверждают безопасность и эффективность фторирования питьевой воды. Но, существуют мнения о его неэффективности и даже опасности. Обоснованных доказательств тому, что фторированная вода укрепляет зубы и кости, на данный момент не предоставлено.
Также известно и то, что если длительное время употреблять фтор, это может привести к печальным последствиям — к возникновению остеопороза, остеомиелиту, болезни и изменению зубов (флюороз), заболеваниям мозга
Некоторые ученые осторожно высказывают мнение, что возможна связь между ростом частоты возникновения болезни Альцгеймера и фторированием воды. Фтор не выводится быстро из организма, но накапливается в костях и зубах
Недавно также было обнаружено, что он накапливается еще более интенсивно в шишковидной железе, находящейся в середине мозга.
Электронное строение
Применение метода МО для молекулы F2 Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
Применение в химической деятельности (химической промышленноси)
Газообразный фтор используется для получения:
гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности. трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами фреонов — хороших хладагентов тефлонов — химически инертных полимеров гексафтороалюмината натрия — для последующего получения алюминия электролизом различных соединений фтора
Применение Фтора

Применение фтора очень разнообразно. Ежегодная добыча фторсодержащей руды составляет около 6 миллионов тонн. Значительная часть добытого фтора уходит в металлургию. С помощью фторированного флюса выплавляют чугун и алюминий. К примеру, для получения одной тонны алюминия необходимо около 23 килограммов фтора. Так же фтор используется в ядерной промышленности для обогащения урана с помощью ядерной диффузии. Еще одним местом применения является энергетическая промышленность. Около 6 тысяч тонн фтора ежегодно используется в качестве диэлектрика в высоковольтных трансформаторах. Так же фтор очень широко распространен в медицине. Около 20% всех медицинских препаратов содержат этот химический элемент. Еще одним очень широко распространенным фторсодержащим продуктом являются различного рода хладогенты. Для справки, это вещества которые используются в системах кондиционирования воздуха. В общем, у фторсодержащих элементов огромный круг применения.
Читайте: Бор как химический элемент таблицы Менделеева
Фториды в питьевой воде
Всё чаще можно услышать о таком явлении, как «фторирование». В питьевой воде наших регионов содержание фтора понижено. Это приводит к проблемам с зубной эмалью и костным изменениям. Поэтому учёные специально обогащают воду этим микроэлементом.
Процесс нормированного внедрения фторсодержащих веществ в состав воды и называется «фторирование».
Такой процесс не приводит к изменениям относительно запаха, вкуса и вида. Оптимальный показатель достаточного уровня этого элемента – 1 мг на литр. Более 80% регионов России не дотягивают до этого показателя. Первое место по дефициту занимают Северные районы.
Перечень показателей для проведения фторирования:
- Повышенные данные региона по заболеванию кариесом;
- Пониженные показатели содержания фтора в воде, применимой для питьевого использования (менее 0,5 мг в литре);
- Отсутствие в регионе программ по иным профилактикам дефицита (не проведение мер по фторированию молочной продукции, соли и производству таблеток с содержанием этого элемента).
Проводится этот процесс коммунальными службами, отвечающими за водоснабжение района в соответствии с государственными программами здравоохранения.
Каждый человек может сам понять уровень содержания фтора в поступающей к нему в кран воде, спросив об этом службы водоканала города.
При недостаточности обогащения воды фтором стоит использовать специальные фильтры домашнего применения, установив соответствующие картриджи. Производители этих приборов на каждом номерном ряде картриджей указывают дополнительные свойства и их назначения.
Также сбалансированную по норме на содержание фторидов воду для питья производят фирмы, выпускающие детское питание.
В районах и отдалённых населённых пунктах, где отсутствует водопроводное снабжение, осуществляют местное фторирование. Добавляют раствор элемента непосредственно в ёмкость (баки), из которой поступает вода населению.

Методы фторпрофилактики
Существует два основных метода фторпрофилактики – системная и местная.
Системная – это употребление фтора внутрь. Фтор может поступать в наш организм с фторированными водой, молоком, солью и в составе специальных таблеток. В конечном итоге он оказывает свое профилактическое и лечебное воздействие, выделяясь в полости рта со слюной.
Местная фторпрофилактика – это использование препаратов со фтором наружно, непосредственно нанося их на зубы. Эффективность таких препаратов зависит от нескольких факторов:
– от химического соединения фтора, его свойств и концентрации;
– лекарственной формы препарата, частоты его применения;
– от свойств полости рта (эмали, ротовой жидкости, гигиены).
Применение фтора:
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
- https://en.wikipedia.org/wiki/Fluorine
- https://de.wikipedia.org/wiki/Fluor
- https://ru.wikipedia.org/wiki/Фтор
- http://chemister.ru/Database/properties.php?dbid=1&id=219
- https://chemicalstudy.ru/ftor-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: Фото https://www.pexels.com, https://pixabay.com
Найти что-нибудь еще?
карта сайта
фтор атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решеткаатом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома электронные формулы сколько атомов в молекуле фторасколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
741
Нахождение фтора в природе. Где содержится фтор?
В свободном состоянии вторник можно встретить в окружающей среде, так как он является частью соединений с различными элементами. При определенных условиях они распадаются, образуя ионы фтора.
В качестве соединений фтора можно найти в почве, воде, продуктах питания. Данный элемент является жизненно необходимым для здоровья человека, однако, при этом он обладает также и негативными качествами. количество фтора в организме не должна превышать дозволенного сутки нормы, так как это может привести к негативным последствиям. Врачи считают, что взрослому человеку достаточно от 0, 5 ммг до 1-2 ммг. При попадании большего количества фтора в организм могут возникнуть осложнения.
Дополнительная информация
Фториды Соединения фтора в ракетной технике Соединения фтора в медицине Категория:Соединения фтора
Фтор, Fluorum, F(9)
Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла. Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов. Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
Фториды металлов
Фториды щелочных, щелочноземельных металлов и переходных металлов в низших степенях окисления (трифториды редкоземельных элементов и актиноидов, моно- ди- и трифториды d-элементов) имеют ионную структуру и являются солями фтороводородной (плавиковой) кислоты. Для таких ионных фторидов характерны высокие значения энергии кристаллической решетки и, соответственно, высокие температуры плавления и кипения: для CaF2 Tпл = ~2530oC.
При увеличении степени окисления характер связи между фтором и металлом во фторидах переходных металлов становится ковалентным и соответственно изменяются свойства фторидов: так, например, гексафторид урана UF6 при атмосферном давлении возгоняется при 56,4 °C и под давлением 1,44 МПа плавится при 64 °C.
Координационное число кристаллической решетки фторидов металлов зависит от размера катиона: в случае малого радиуса катиона координационное число равно четырём (например, для BeF2 с тетраэдрическими окружением анионами фтора катиона бериллия), при увеличении радиуса катиона координационное число увеличивается до шести (например, UF6 с октаэдрическим оккружением атомами фтора атома урана).
Чем полезен фтор
Фтор выполняет важные задачи в организме.
- Вместе с фосфором и кальцием участвует в образовании и укреплении костной ткани и зубной эмали.
- Способствует здоровому росту ногтей и волос.
- Стимулирует процессы кроветворения: формирование, развитие и созревание эритроцитов, тромбоцитов и лейкоцитов.
- Укрепляет иммунитет и поддерживает его на соответствующем уровне.
- Выводит из организма соли радионуклидов и тяжёлых металлов.
В составе средств по уходу за полостью рта фтор помогает избежать проблем с зубами и решить уже существующие.
- Предотвратить кариес. Фтор проникает в структуру эмали, предотвращает кариес и лечит его на стадии белого пятна.
- Защитить от деминерализации. Соединение фтора с гидроксиапатитом (главным элементом зубной эмали) образует фторгидроксиапатит — вещество, которое её восстанавливает. Так происходит реминерализация эмали.
- Защитить от молочной кислоты. Фтор мешает бактериям вырабатывать молочную кислоту. Это снижает рост патогенной микрофлоры и даёт эмали дополнительную защиту.
Химические свойства и применение фтора
Соли фтора используют в зубных пастах как микроэлементы, необходимые для организма. Также углеводороды с содержанием фтора используются в медицине как кровозаменители. Также фтор входит в другие сильные окислители, такие как фторид ксенона 6 (XeF6) или фторид азота 3 (NF3), последний является бесцветным ядовитым газом, растворимым в воде и относительно инертным при нормальных условиях, но при повышенной температуре является черезвычайно активным окислителем и сильным фторирующем агентом. Трифторид азота используют при получении углеводородов, в частности для тетрафторида углерода (CF4), т.к. при фторировании парафинов (алканов) на свету реакция течет по свободно-радикальному механизму и образуются несколько продуктов. Только у фтора нет оксидов, т.к. из-за его электроотрицательности (способность атома химического элемента, находясь в молекуле, притягивать к себе общие электронные пары, или, другими словами, оттягивать к себе электроны других атомов) в реакции с кислородом он образует фторид кислорода OF2 и диоксифторид O2F2. Многие вещества, не горящие при нормальных условиях способны гореть в среде фтора, например, вода воспламеняется даже при комнатной температуре в его среде, образуя при горении красивое синее пламя, свет которого схож с солями меди и кальция при том же самом горении. Или же огнеупорный асбест в среде фтора горит не хуже бумаги, притом заметим, что последняя в свою очередь моментально вспыхивает и сгорает в среде, напоминая горение нитроцеллюлозы (целлюлозы, обработанной азотной кислотой) в атмосфере воздуха.
Симптомы флюороза зубов
Признаки флюороза:
- появление симметричных белых пятен на зубах;
- потеря блеска эмали, её матовость;
- наличие сколов зубов, так как эмаль становится хрупкой;
- повышенная стираемость зубов.
Первые проявления флюороза возникают у детей, которые родились в районах с повышенным содержанием фтора или переехали в эту местность, когда им было меньше 4 лет. Это связано с низкой минерализацией эмали у детей, также имеет значение состояние иммунной системы. Нужно отметить, что флюорозу подвержены только постоянные зубы, молочные зубы при этом не страдают.
Сначала флюороз затрагивает резцы. Если поступление избыточного количества фтора продолжается, вовлекаются все группы зубов. Изменения происходят в зубной эмали. В поражённых участках эмаль теряет блеск и прозрачность, приобретает матовость, становится тусклой и пористой, на ней появляются белые пятна. Это объясняется особенностями светопреломления эмали, структура которой нарушена вследствие длительного воздействия фтора и нарушения процесса минерализации.
При содержании фтора от 2 мг/мл и выше образования на эмали становятся более выпуклыми, а количество пятен увеличивается в разы. В зависимости от степени тяжести флюороза белыми пятнами покрывается от 25 % коронковой части зуба при лёгкой степени до 100 % при тяжёлой степени. Наличие тёмных, деструктивных элементов, ведущих к разрушению зубов, характерно для тяжёлой степени. При такой клинической картине отмечается повышенная чувствительность зубов от термических раздражителей, так как дефекты проникают в глубокие слои дентина.
Другие гастрономические рекомендации
Придумать богатое фтором меню не составит никаких трудностей. Главное знать, в каких продуктах и в какой концентрации содержится этот минерал.
Все супы, приготовленные на костях, и бульоны из птицы (мясо должно быть также с костями) являются не только сытным блюдом, но и чрезвычайно концентрированным источником F. Хотя есть одно замечание. Желаете быть уверенными в пользе такого бульона – позаботьтесь о качестве мяса. И если нет возможности есть домашнюю птицу, то, по крайней мере, покупайте продукт от проверенных производителей.
Конечно, свежеприготовленная пища – это вкуснее и полезнее всего. Но и консервы не всегда плохо. Рыбные, например, (особенно с костями) являются одним из лучших продуктовых источников F
Но в этом случае также важно проверить качество и свежесть продукта
Категорически не приемлете консервы? Не беда. Рыба, приготовленная самостоятельно, ничем не хуже. А по вкусу – лучше во много раз. Единственно правило: варить, тушить, запекать или жарить рыбу желательно с костями. Такой продукт содержит в себе в разы больше фтора, чем филе тех же сортов. Продолжая тему даров моря, стоит напомнить, что моллюски также благотворно влияют на состояние костей и зубов.
Овсянка принадлежит к списку продуктов, богатых микроэлементами, в частности фтором. Но маленькое предостережение. Все-таки лучше отдавать предпочтение обычным «геркулесовым» хлопьям, чем новомодным кашам, быстрого приготовления, напичканным усилителями вкуса и химическими «Е»-добавками. В связи с этим, повезло любителям проросших зерен – они получают от злаков больше всего пользы.
Фруктовые и овощные соки – в числе продовольствий, насыщенных фтором. Но опять-таки, полезными могут называться только свежевыжатые фреши из качественных продуктов. Выращенное «на химии» не стоит выбирать в качестве сырья для витаминного напитка. От таких соков вреда больше, чем пользы. И конечно же, лучше навсегда забыть о существовании напитков, изготовленных из концентратов.
Роль фтора в организме человека
В организме человека содержится около 2,5-2 г этого микроэлемента, причем в основном он присутствует в костной ткани и зубной эмали. Совместно с кальцием и фосфором он отвечает за крепость костей, за созревание и затвердение зубной эмали, предупреждает развитие кариеса. Важен он также для профилактики остеопороза, улучшает сращение костной ткани после переломов.
Помимо поддержания здоровья костей и зубов, микроэлемент выполняет и другие важные функции. Роль фтора в организме человека:
- участвует в кроветворении, способствует формированию и развитию лейкоцитов, эритроцитов, тромбоцитов;
- уменьшает продукцию молочной кислоты, которая вредит мышечной массе;
- способствует росту и укреплению ногтей, волос;
- выводит радионуклиды и соли тяжелых металлов из организма, снижает лучевую нагрузку;
- способствует укреплению иммунитета;
- улучшает усвоение железа.
Фтор достаточно часто добавляют в зубные пасты. Он снижает активность кислотообразующих бактерий, предотвращает развитие кариеса и пародонтоза, защищает эмаль от деминерализации. Но вот такие пасты лучше не использовать для детей младшего возраста, поскольку их нельзя глотать.
Польза и вред фтора для человека: самые радикальные тезисы «за» и «против»
| ЗА | ПРОТИВ |
|
|