Строение атома кислорода
Описанные свойства кислорода в первую очередь объясняются внутренним строением этого элемента.
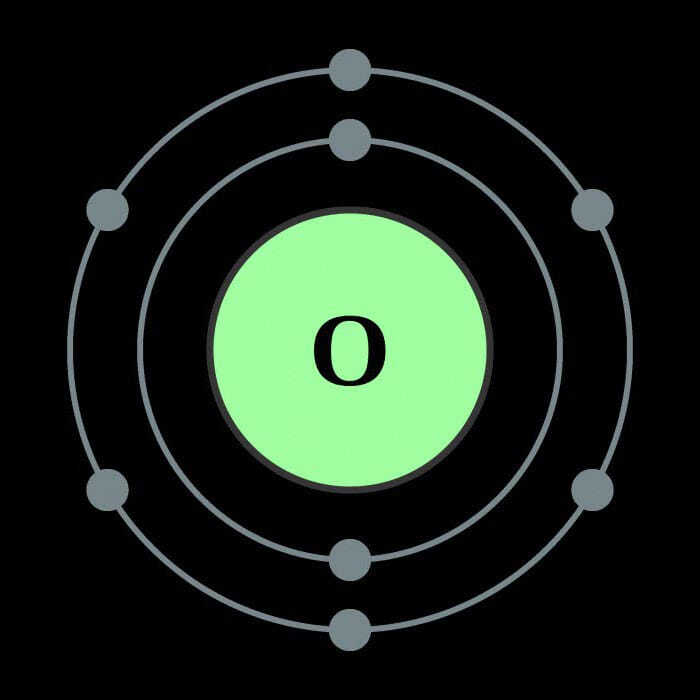
Кислород относится к главной подгруппе шестой группы элементов периодической системы. Во внешнем электронном облаке элемента находятся шесть электронов, четыре из которых занимают p-орбитали, а оставшиеся два располагаются на s-орбиталях. Такое внутреннее строение обуславливает большие энергетические затраты, направленные на разрывание электронных связей – атому кислорода проще заимствовать два недостающих электрона на внешнюю орбиталь, чем отдать свои шесть. Поэтому ковалентность кислорода в большинстве случаев равна двум. Благодаря двум свободным электронам кислород легко образует двухатомные молекулы, которые характеризуются высокой прочностью связи. Лишь при прилагаемой энергии свыше 498 Дж/моль молекулы распадаются, и образуется атомарный кислород. Химические свойства этого элемента позволяют ему вступать в реакции со всеми известными веществами, исключая гелий, неон и аргон. Скорость взаимодействия зависит от температуры реакции и от природы вещества.

Кислородотерапия в реабилитации после коронавирусной инфекции
Основная проблема при коронавирусе – развитие у больных гипоксемии (падение уровня кислорода в крови) на фоне острой дыхательной недостаточности (ОДН). Длительно существующую ОДН и гипоксию часто осложняют состояния, угрожающие жизни: острый респираторный дистресс-синдром, септический шок, полиорганная недостаточность.
Для поддержания дыхательной функции, лечения гипоксии и профилактики осложнений применяются различные виды респираторной терапии.
Варианты респираторной поддержки у больных с COVID-19
- оксигенотерапия (кислородная терапия);
- высокопоточная назальная оксигенотерапия;
- неинвазивная вентиляция легких – НИВЛ;
- инвазивная искусственная вентиляция легких (ИВЛ).
Выбор методики и оборудования зависит от состояния пациента и тяжести дыхательной недостаточности.
Кислородный коктейль
Кислородный коктейль – это напиток, насыщенный кислородом. Представляет собой густую, с высокой концентрацией кислорода пену. Готовится на основе сока, морса, травяного чая или любого другого не газированного напитка без мякоти.
В середине прошлого века советские ученые доказали, что кислород всасывается и транспортируется к внутренним органам не только в легких, но и в желудке.
Изначально кислородный напиток использовали как целебное средство только в лечебно-оздоровительных учреждениях – санаториях и больницах.
Необходимо помнить, что оздоровление кислородными коктейлями имеет ряд противопоказаний, поэтому следует проконсультироваться с врачом.
Кардиологический санаторный центр «Переделкино»
В КСЦ «Переделкино» кислородотерапия применяется в медицинских программах Лечение и Кардиопрофилактика.
Также кислородную терапию используют в восстановлении после коронавирусной инфекции.
Получить процедуру кислородотерапии можно находясь на амбулаторном лечении в КСЦ «Переделкино».
Для проведения кислородной терапии в санатории используется кислородный концентратор LFY-1-SA
Подробнее о кислородотерапии в КСЦ «Переделкино» можно узнать у консультанта на нашем сайте
Атом и молекула кислорода. Формула кислорода. Строение кислорода:
Кислород – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением О и атомным номером 8. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), втором периоде периодической системы.
https://youtube.com/watch?v=xrnupfHJJ-o
Кислород самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева из группы халькогенов.
Кислород – химически активный неметалл.
Кислород обозначается символом О.
Как простое вещество кислород (химическая формула O2) при нормальных условиях представляет собой двухатомный газ без цвета, вкуса и запаха. В жидком состоянии кислород имеет светло-голубой цвет, а в твёрдом – представляет собой кристаллы светло-синего цвета.
Молекула кислорода двухатомна. Также встречается аллотропная модификация кислорода – озон, молекула которого состоит из трёх атомов кислорода.
Химическая формула кислорода O2 (или O3 – озон).
Электронная конфигурация атома кислорода 1s2 2s2 2p4. Потенциал ионизации (первый электрон) атома кислорода равен 1313,94 кДж/моль (13,618055(7) эВ).
Строение атома кислорода. Атом кислорода (наиболее распространенный из трех изотопов кислорода (99,757 %) – 168О) состоит из положительно заряженного ядра (+8), вокруг которого по атомным оболочкам движутся восемь электронов. При этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поскольку кислород расположен во втором периоде, оболочки всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлена s- и р-орбиталями. Два спаренных электрона находится на 1s-орбитали, вторая пара электронов – на 2s-орбитали. На 2р-орбитали находится два спаренных и два неспаренных электрона. Поэтому во всех своих соединениях кислород проявляет валентность II. В свою очередь ядро атома кислорода состоит из восьми протонов и восьми нейтронов. Кислород относится к элементам p-семейства.
Радиус атома кислорода (вычисленный) составляет 48 пм.
Атомная масса атома кислорода составляет 15,99903-15,99977 а. е. м.
Кислород – самый распространённый химический элемент на Земле. В земной коре на его долю в составе различных соединений приходится около 46 % массы. Морские и пресные воды содержат по массе 86 % кислорода (если быть точнее – 85,82 %). В человеке его содержание составляет по массе 61 %. В атмосфере содержание свободного кислорода составляет 20,9476 % по объёму и 23,15 % по массе. На Солнце – 0,9 %, а во Вселенной – 1 %.
При высокой температуре молекула кислорода О2 обратимо диссоциирует на атомарный кислород. При 2000 °C на атомарный кислород диссоциирует 0,03 % молекулярного кислорода, при 2600 °C – 1 %, при +4000 °C – 59 %, при 6000 °C — 99,5 %.
Атомарный кислород, озон и влияние на человека: озон после грозы в лесу, видео Неумывакин

Озон после грозы в лесу
Атомарный кислород имеет просто удивительные свойства, мало того что он способен стимулировать работу мозга и помогает снять усталость, так еще и выводит из похмелья уничтожая ядовитый алкоголь в организме. Но это еще не все, вот еще влияние атомарного кислорода на человека:
- Он способен повышать работоспособность и тонус организма, а также омолаживать кожу. Естественно, благодаря этому будет улучшаться внешний вид.
- Уничтожает старые клетки и участвует в создание новых.
- Корректирует резонансную частоту клеток, поддерживая иммунную систему при этом управляя практически всеми параметрами организма.
- Также он используется для текстурирования полимеров и делает их способными срастаться с костью. Полимеры обычно отталкивают клетки костной ткани, но химически активный элемент создает фактуру, усиливающую адгезию.
Это обуславливает еще одну пользу, которую приносит атомарный кислород – лечение заболеваний опорно-двигательной системы. Озон также может быть полезным:
- Способен подавлять вирусы ( фактически уничтожать).
- Также он укрепляет иммунную систему, нормализует давление.
- Оздоравливает и омолаживает клетки.
После грозы в лесу можно также наблюдать озон. Вам будет пахнуть свежестью, воздух будет с синевой и чистым. Это отличная озонотерапия, которая очень полезна и необходима для организма.
Итак, теперь понятно, что озонотерапию можно получить в лесу после грозы. Но где взять атомарный кислород? Самое интересное то, что перекись водорода является источником атомарного кислорода. Впервые об этом на широкую публику начал говорить профессор Неумывакин. Он сам смог вылечиться перекисью водорода от онкологии и теперь пропагандирует такое лечение в массы. Посмотрите видео. В нем профессор рассказывает о полезных свойствах перекиси водорода, атомарного кислорода и как проводить лечение.
Применение кислорода
Помимо того, что все живые существам в природе, за исключением немногих микроорганизмов, при дыхании потребляют кислород, он широко применяется во многих отраслях промышленности: металлургической, химической, машиностроении, авиации, ракетостроении и даже в медицине.

В химической промышленности его применяет:
- при получении ацетилена из природного газа (метана);
- при производстве кислот (азотной, серной);
- для газификации твердого топлива;
- для производства аммиака, формальдегида и метанола.
В металлургии его используют:
- при получении цветных металлов из руд;
- при выплавке чугуна в доменных печах;
- при выплавке стали в мартеновских и электрических печах;
- кислородно-конверторной выплавке стали.
В медицинских целях больным, у которых нарушена нормальная деятельность органов дыхания или кровообращения, искусственно увеличивают содержание O2 в воздухе или дают дышать непродолжительное время чистым O2. Медицинский кислород, выпускаемый ГОСТ 5583, особенно тщательно очищают от всех примесей.
Применение кислорода в сварке
Сам по себе O2 является негорючим газом, но из-за свойства активно поддерживать горение и увеличения интенсивности (интенсификации) горения газов и жидкого топлива его используют в ракетных энергетических установках и во всех процессах газопламенной обработки. В таких процессах газопламенной обработки, как газовая сварка, поверхностная закалка высокая температура пламени достигается путем сжигания горючих газов в O2, а при газовой резке благодаря ему происходит окисление и сгорание разрезаемого металла.
При полуавтоматической сварке (MIG/MAG) кислород O2 используют как компонент защитных газовых смесей с аргоном (Ar) или углекислым газом (CO2).
Кислород добавляют в аргон при полуавтоматической сварке легированных сталей для обеспечения устойчивости горения дуги и струйного переноса расплавленного металла в сварочную ванну. Дело в том, что как поверхностно активный элемент он уменьшает поверхностное натяжение жидкого металла, способствуя образованию на конце электрода более мелких капель.
При сварке низколегированных и низкоуглеродистых сталей полуавтоматом O2 добавляют в углекислый газ для обеспечения глубокого проплавления и хорошего формирования сварного шва, а также для уменьшения разбрызгивания.
Чаще всего кислород используют в газообразном виде, а в виде жидкости используют только при его хранении и транспортировке от завода-изготовителя до потребителей.
Биологическая роль кислорода
Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
§23. Свойства кислорода
1. Охарактеризуйте физические и химические свойства кислорода. Составьте уравнения соответствующих химических реакций. Под формулами вещества напишите их названия, а над формулами проставьте валентность элементов в соединениях.
2. Как может протекать взаимодействие веществ с кислородом?Кислород энергично реагирует со многими веществами:простыми – металлами и неметаллами и сложными. Химические реакции взаимодействия веществ с кислородом называются реакциями окисления. Химическая реакция, при которой происходит окисление веществ с выделением тепла и света называется реакцией горения. Продуктами реакций взаимодействия веществ с кислородом, в большинстве случаев, являются оксиды. Существует значительное число случаев окисления, которые мы не можем назвать процессами горения, ибо они протекают столь медленно, что остаются не заметными для наших органов чувств.
3. Приведите примеры медленного взаимодействия веществ с кислородом.Существует значительное число случаев окисления, которые мы не можем назвать процессами горения, ибо они протекают толь медленно, что остаются не заметными для наших органов чувств. Лишь по прошествии определенного, часто весьма продолжительного времени мы можем уловить продукты окисления. Так, например, обстоит дело при весьма медленном окислении (ржавлении) металлов или при процессах гниения. Примеры взаимодействия веществ с кислородом без выделения света: гниение навоза, листьев, прогорание масла, окисление металлов (железные форсунки при длительном употреблении становятся тоньше и меньше), дыхание аэробных существ, т.е. дышащих кислородом, сопровождается выделением теплоты, образованием углекислого газа и воды.
4. Какие вещества называют оксидами? Напишите уравнения химических реакций, в результате которых образуются оксиды следующих химических элементов: а) кремния; б) цинка; в) бария; г) водорода; д) алюминия. Дайте названия этим оксидам.Оксид (окисел) – бинарное соединение химического элемента с кислородом в степени окисления -2, в котором сам кислород связан только с менее электроотрицательным элементом.

5. При разложении основного карбоната меди (минерала малахита) CuCO₃·Cu(OH)₂ образуются три оксида. Напишите уравнение этой реакции.CuCO₃·Cu(OH)₂ = 2CuO+CO₂+H₂O
6. Составьте уравнения реакций, протекающих при горении: а) фосфора; б) алюминия.а) 4P+5O₂ = 2P₂O₅б) 4Al+3O₂ = 2Al₂O₃
7. Определите, какое из соединений железа — Fe₂O₃ или Fe₃O₄ — богаче железом.
ТЕСТОВЫЕ ЗАДАНИЯ
1. Определите вещество по описанию: бесцветный газ, без вкуса и запаха, малорастворим в воде. При давлении 760 мм рт.ст. и температуре -218,8°С затвердевает:Кислород.
2. Реакция горения фосфора в кислороде относится к реакциям:Соединения.
Сера
Химический элемент сера расположен в 3-м периоде VIA подгруппе. Его электронная формула 1s22s22p63s23p4. Простое вещество сера — неметалл жёлтого цвета. Существует в двух аллотропных модификациях: ромбическая и моноклинная и в аморфной форме (пластическая сера). Проявляет как окислительные, так и восстановительные свойства. Возможны реакции диспропорционирования. Её характерные химические свойства:

Сера образует летучее водородное соединение — сероводород. Его водный раствор представляет собой слабую двухосновную кислоту. Для сероводорода характерны также восстановительные свойства:
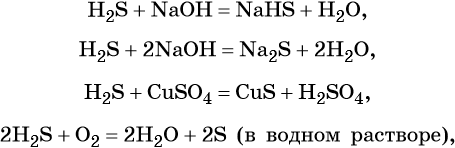
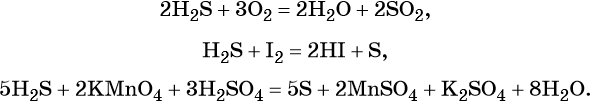
Сера образует два кислотных оксида: оксид серы (IV) SO2 и оксид серы (VI) SO3. Первому соответствует слабая, существующая только в растворе сернистая кислота H2SO3; второму — сильная двухосновная серная кислота H2SO4. Концентрированная серная кислота проявляет сильные окислительные свойства. Ниже приведены характерные для этих соединений реакции:
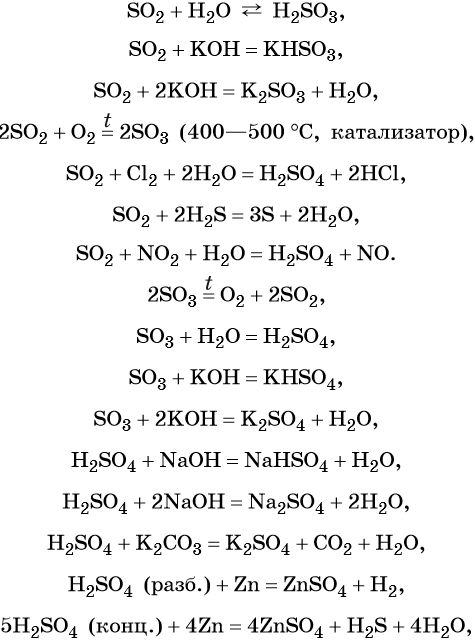
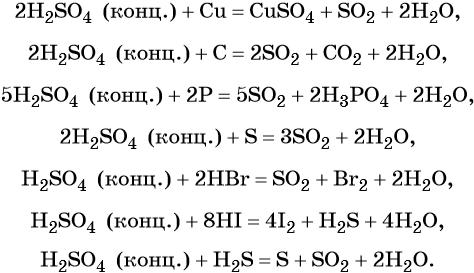
Серная кислота в больших количествах производится в промышленности. Все промышленные методы производства серной кислоты основаны на первоначальном получении оксида серы (IV), его окислении в оксид серы (VI) и взаимодействии последнего с водой.
Подробности
Если в баллоне находится сухой кислород…
то это окисление железа идет очень медленно, и только в тонком поверхностном слое. И на стенке образуются окислы, в виде сплошной плёнки, и они не дают дальше идти процессу окисления. И если в баллоне отсутствуют влага, то можно много лет эксплуатировать баллон, и у него не будет заметной коррозии металла.
Также в кислороде могут гореть углеродистая сталь, если присутствует достаточное количество тепла при соприкосновении, и металл имеет незначительную массу. Такое может быть при трении тонких пластин о большие детали машин, если есть частицы стружки или железного порошка.
Для избегания ситуаций по возникновению пожара нужно следить за тем, чтобы доля кислорода в помещениях не превышала 23%.
Каждому человеку для жизни необходимо дышать кислородом
…, однако если длительное время вдыхать в себя чистый кислород, то органы дыхания и лёгкие могут быть поражены.
Поэтому при работе, хранении и транспортировке кислорода обязательно нужно соблюдать правила безопасности, и следить за тем, чтобы кислород не был в контакте с другими горючими и легковоспламеняющимися веществами. Рабочие, сварщики, все кто работает с кислородом, не должны одевать во время рабочего процесса одежду, на которой есть следы масла или смазки. Баллоны, и другую рабочую аппаратуру обязательно нужно обезжиривать. И в рабочем процессе постараться исключить попадание масел и жиров на поверхность детали, которые работают в контакте с кислородом.
Причина взрыва в кислородных баллонах
Основная причина взрыва кислородного баллона это высокая активность кислорода, потому что он сильный окислитель. Большинство горючих материалов и веществ при взаимодействии с кислородом могут быть взрывоопасными, есть угроза пожара.

В основном кислород может взорваться при возникновении давления, резком повышении температуры, и увеличении доли кислорода в объеме воздуха.
Если металлические детали кислородного баллона стали загрязнены маслом и другими смазочными жидкостями, которые взаимодействуют с кислородом, это также может привести к возгоранию или взрыву.
Воздействие на здоровье
Кислород необходим для всех форм жизни, так как он является составной частью ДНК и почти всех других биологически важных соединений. В лёгких этот элемент поглощается атомом железа в центре гемоглобина в крови и, таким образом, транспортируется туда, где он необходим.
Каждый человек нуждается в этом элементе, чтобы дышать, но, как и во многих случаях, слишком большое его количество вредно. Если человек подвергается воздействию большого количества О2 в течение длительного времени, может произойти повреждение лёгких. Вдыхание 50−100% кислорода при нормальном давлении в течение длительного периода приводит к повреждению лёгких. Люди, которые работают с частым или потенциально высоким воздействием чистого элемента, должны пройти тесты на функционирование лёгких до начала работы и по завершении.
Ссылки
- Шивер и Аткинс. (2008). Неорганическая химия. (Четвертый выпуск). Мак Гроу Хилл.
- Википедия. (2020). Аллотропы кислорода. Получено с: en.wikipedia.org
- Хоун, К.А., Каппе, К.О. (2019). Использование молекулярного кислорода для жидкофазного аэробного окисления в непрерывном потоке.Топ Curr Chem (Z)377, 2. doi.org/10.1007/s41061-018-0226-z
- Кевин Бек. (28 января 2020 г.). 10 видов использования кислорода. Получено с: sciencing.com
- Cliffsnotes. (2020). Биохимия I: химия молекулярного кислорода. Получено с: cliffsnotes.com
- GZ Industrial Supplies. (2020). Промышленные преимущества газообразного кислорода. Получено с: gz-supplies.com
Анализ публикаций по теме исследования
Для анализа и расчёта равновесного состава газовой фазы металлургической системы ограничиваются применением модели идеальных газовых смесей с использованием следующих параметров: температура и давление в системе, парциальное давление компонента и величина константы равновесия реакции в газовой фазе. Считается, что отклонения от идеальности при металлургических температурах в диапазоне давлений, наблюдаемых в агрегате, ниже десятых долей процента, что достаточно для точности прогнозных оценок. Если в состав атмосферы входит кислород, то при написании химических реакций и в дальнейших термодинамических расчётах всегда фигурирует двухатомный кислород О2 , так как «в пределах температур, характеризующих металлургические процессы, элементарный кислород является всегда двухатомным. Диссоциацией его на атомы, а также образованием озона (О3) при существующих условиях можно пренебречь» . И только при температурах более 2500oС рекомендуется учитывать присутствие в газовой фазе заметных количеств атомарных частиц и радикалов .
В качестве параметра окислительных свойств кислородсодержащей газовой фазы металлургической системы предлагается окислительный потенциал П , определяющийся как
где R – универсальная газовая постоянная, Дж/моль*К; Т – температура, К; PO2 — парциальное давление двухатомного кислорода, Па.
Как видно из выражения (1) окислительные свойства газовой фазы определяются только содержанием двухатомного кислорода. Однако в восстановительных металлургических процессах и процессах раскисления равновесное парциальное давление двухатомного кислорода уменьшается на порядки (до величин ниже 10-4 Па) в сравнении с составом окислительной атмосферы агрегатов. В этом случае, согласно принципу Ле-Шателье – Брауна, в газовой фазе должно возрасти парциальное давление атомарного кислорода и его концентрацией пренебрегать нельзя. Тогда и оценивать кислородный потенциал газовой фазы только по значению парциального давления двухатомного кислорода нельзя. То есть, для восстановительных условий выражение (1) может быть неприменимо.
Кислород, свойства атома, химические и физические свойства.
О 8 Кислород
15,99903-15,99977* 1s2 2s2 2p4
Кислород — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 8. Расположен в 16-й группе (по старой классификации — главной подгруппе шестой группы), втором периоде периодической системы.
Атом и молекула кислорода. Формула кислорода. Строение кислорода
Изотопы и модификации кислорода
Свойства кислорода (таблица): температура, плотность, давление и пр.
Физические свойства кислорода
Химические свойства кислорода. Взаимодействие кислорода. Реакции с кислородом
Получение кислорода
Применение кислорода
Таблица химических элементов Д.И. Менделеева
https://youtube.com/watch?v=RJFpSt10G6E
https://youtube.com/watch?v=_EING_B8boA
https://youtube.com/watch?v=-kem8rOavEo
[править] Применение
Кислород воздуха имеет чрезвычайно важное значение для процессов горения. Сжигая различные виды топлива, получают тепло, которое используют для удовлетворения самых различных потребностей, в том числе для преобразования его в механическую и электрическую энергию
При участии кислорода воздуха сгорает топливо на теплоэлектростанциях, топливо в двигателях автомобилей, выжигают металлические руды на заводах цветной металлургии.
Сварка и резка металлов
Чистый кислород с ацетиленом широко используют для так называемой автогенной сварки стальных труб и других металлических конструкций и их резки. Для этого служит специальная горелка, который состоит из двух металлических трубок, вставленных друг в друга. В пространство между трубками пропускают ацетилен и зажигают, а затем по внутренней трубке пропускают кислород. Оба газа, подаются из баллонов под давлением. Температура в кислородно-ацетиленовом пламени — до 2000 ° C, при такой температуре плавится большинство металлов.
В медицине
Кислород — биогенный химический элемент, обеспечивающий дыхание большинства живых организмов на Земле. Физиологическое действие кислорода разностороннее, решающее значение в его лечебном эффекте имеет способность возмещать дефицит кислорода в тканях организма при гипоксии (недостаточного снабжения тканей кислородом или нарушения его усвоения).
Ингаляцией (вдыханием) кислорода широко пользуются при различных заболеваниях, сопровождающихся гипоксией (нехваткой кислорода): при заболеваниях органов дыхания (пневмония, отек легких и т. д.), сердечно-сосудистой системы (сердечная недостаточность, коронарная недостаточность, резкое падение артериального давления и т. п.), отравлениях угарным газом, синильной кислотой, удушающими веществами (хлор, фосген и др.), а также при других заболеваниях с нарушением функции дыхания и окислительных процессов.
В анестезиологической практике кислород широко применяется в смеси с ингаляционными наркотическими анальгетиками. Чистым кислородом и смесью его с углекислотой пользуются при ослаблении дыхания в послеоперационном периоде, при интоксикациях и т. д.
Широко пользуются кислородом для так называемой гипербарической оксигенации — применения кислорода под повышенным давлением. Установлена высокая эффективность этого метода в хирургии, интенсивной терапии тяжелых заболеваний, особенно в кардиологии, реаниматологии, неврологии и других областях медицины.
Применяют также энтеральную оксигенотерапию (введение кислорода в кишечник или желудок) путем введения в желудок кислородной пены, применяемой в виде так называемого кислородного коктейля. Используется для общего улучшения обменных процессов в комплексной терапии сердечно-сосудистых заболеваний, нарушений обмена веществ и других патологических состояний, связанных с кислородной недостаточностью организма.
Чистым кислородом пользуются для дыхания также летчики при высоких полетах, водолазы, на подводных лодках и т. п.
Кислородные подушки применяют при некоторых заболеваниях для облегчения дыхания.
Физические свойства
В мировом океане содержание растворённого O2 больше в холодной воде, а меньше — в тёплой
Жидкий кислород
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его имеет массу 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C). Хорошо растворяется в перфторированных углеводородах (20-40 об/об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.
Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость.
Фазовая диаграмма O2
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы. Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-O2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°.
- β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°.
- γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å.
Ещё три фазы образуются при высоких давлениях:
- δ-O2 — интервал температур 20—240 K и давление 6—8 ГПа, оранжевые кристаллы;
- ε-фаза, содержит молекулы O4 или O8, существует при давлении от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-On — давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства
Главным химическим свойством кислорода является, конечно же, его поддержка горения. То есть в вакууме, где нет кислорода, огонь не возможен. Если же в чистый кислород опустить тлеющую лучину, то она загорится с новой силой. Горение разных веществ это окислительно-восстановительный химический процесс, в котором роль окислителя принадлежит кислороду. Окислители же это вещества, «отбирающие» электроны у веществ восстановителей. Отличные окислительные свойства кислорода обусловлены его внешней электронной оболочкой.
Валентная оболочка у кислорода расположена близко к ядру и как следствие ядро притягивает к себе электроны. Также кислород занимает второе место после фтора по шкале электроотрицательности Полинга, по этой причине вступая в химические реакции со всеми другими элементами (за исключением фтора) кислорода выступает отрицательным окислителем. И лишь вступая в реакции со фтором кислород имеет положительное окислительное воздействие.
А так как кислород второй окислитель по силе среди всех химических элементов таблицы Менделеева, то это определяет и его химические свойства.
Способы получения, где применяется
В современной промышленности кислород получают из воздуха. Ключевой методикой производства кислорода является криогенная ректификация. Также распространение получили кислородные установки, которые функционируют на основе мембранной технологии. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
С целью соблюсти баланс объемов углекислого газа, который был поглощен, и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях, чтобы уменьшить вес, в некоторых случаях применяют пероксид лития.
Когда в середине ХХ столетия был изобретен турбодетандер, то есть устройство, сжижающее и разделяющее жидкий воздух, кислород начали активно использовать в промышленности. Сферы применения кислорода:
- металлургия, обеспечение конверторной технологии выпуска стали и переработки штейнов, а также сжигание топлива в металлургических агрегатах с помощью кислородно-воздушной смеси;
- сварка и резка металлов с помощью кислорода из баллонов;
- в производстве ракетного топлива используют окислитель в виде жидкого кислорода, пероксида водорода, азотной кислоты;
- медицина, обогащение дыхательных газовых смесей;
- пищевая промышленность, кислород используют, как пищевую добавку Е948, пропеллент и упаковочный газ;
- химическая промышленность: кислород необходим, чтобы выполнять функцию реактива-окислителя в разных синтезах;
- сельское хозяйство, оснащение теплиц, производство кислородных коктейлей, питание животных, обогащение водоемов в рыбоводстве.
Свойства атома кислорода:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 15,99903-15,99977 а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p4 |
| 203 | Электронная оболочка |
K2 L6 M0 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 48 пм |
| 205 | Эмпирический радиус атома | 60 пм |
| 206 | Ковалентный радиус* | 73 пм |
| 207 | Радиус иона (кристаллический) | O2-
124 (4) пм, 126 (6) пм, 128 (8) (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 152 пм |
| 209 | Электроны, Протоны, Нейтроны | 8 электронов, 8 протонов, 8 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 2 |
| 212 | Группа в периодической таблице | 16-ая группа (по старой классификации – главная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
Фосфор
Химический элемент фосфор расположен в 3-м периоде, V группе, главной подгруппе периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p63s23p3.
Простое вещество фосфор существует в виде нескольких аллотропных модификаций (аллотропия состава). Белый фосфор Р4, при комнатной температуре мягкий, плавится, кипит без разложения. Красный фосфор Pn, состоит из полимерных молекул разной длины. При нагревании возгоняется. Чёрный фосфор состоит из непрерывных цепей Pn, имеет слоистую структуру, по внешнему виду похож на графит. Наиболее реакционноспособным является белый фосфор.
В промышленности фосфор получают прокаливанием фосфата кальция с углём и песком при 1500 °C:
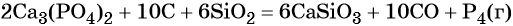
В приведённые ниже реакции вступают любые модификации фосфора, если нет особых оговорок:
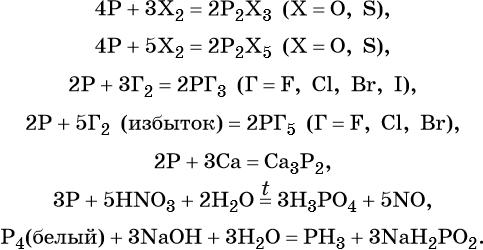
Фосфор образует летучее водородное соединение — фосфин, PH3. Это газообразное соединение с крайне неприятным резким запахом. Его соли в отличие от солей аммиака существуют только при низких температурах. Фосфин легко вступает в окислительно-восстановительные реакции:
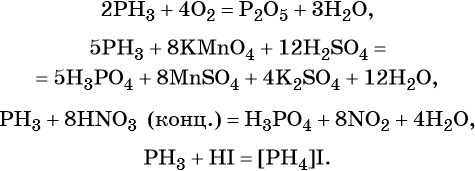
Фосфор образует два кислотных оксида: P2O3 и P2O5. Последнему соответствует фосфорная (ортофосфорная) кислота H3PO4. Это трёхосновная кислота средней силы, которая образует три ряда солей: средние (фосфаты) и кислые (гидро- и дигидрофосфаты). Ниже приведены уравнения химических реакций, характерные для данных соединений:
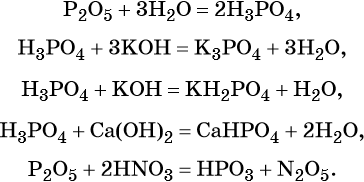
Химическая активность
С подавляющим большинством элементов кислород взаимодействует непосредственно. Исключение составляют золото, галогены и платина. Взаимодействие кислорода с некоторыми веществами значительно ускоряется при наличии катализаторов. Например, смесь водорода и кислорода в присутствии платины вступает в реакцию даже при комнатной температуре
С оглушительным взрывом смесь превращается в обычную воду, важной составной частью которой является кислород. Химические свойства и высокая активность элемента объясняют выделение большого количества света и теплоты, поэтому химические реакции с кислородом часто называются горением

Горение в чистом кислороде происходит гораздо интенсивнее, чем в воздухе, хотя количество теплоты, выделяемой при реакции, будет приблизительно одинаковым, но процесс из-за отсутствия азота протекает гораздо быстрее, а температура горения становится выше.
Нахождение в природе и физические свойства
Кислород (формула O2) — элемент, который наиболее распространен в земной коре (его весовое содержание составляет 49,13%). Также он содержится в воздухе, где его 23%, входит в состав воды (88,9%), во всех оксидах и кислородосодержащих солях. Общая характеристика кислорода при обычных условиях:
- бесцветный газ;
- не имеет запаха;
- плохо растворим в воде (как и в других растворителях);
- сжижается при -183°C, а затвердевает при -219°C.

В таблице периодической системы находится в главной подгруппе (классе) VI группы. Элементы, расположенные здесь, на внешнем электронном слое имеют по 6 электронов, поэтому могут либо присоединять 2 электрона, либо (кроме кислорода) отдавать 4 или 6 электронов. Именно этим и объясняются их физ. и хим. свойства.
При нормальных условиях чистый кислород малоактивен, но в присутствии воды его реакционная способность усиливается. Реакции, которые протекают с участием этого вещества, называются горением. К этому процессу относится и ржавление, а также дыхание (медленное горение).
Примечание: химическая сущность дыхания состоит в соединении углерода и водорода органических веществ с кислородом.






