В каких продуктах содержится кобальт. Витамины и препараты, содержащие кобальт
Как правило, препараты кобальта прописывают при различного рода анемиях и нарушениях кроветворной функции. К таким лекарственным формам относится:
- Коамид;
- Ферковен.
Входит кобальт и в состав поливитаминных комплексов:
- Компливит. Содержит 100 мкг кобальта в виде сульфата.
- Олиговит. Содержит 50 мкг элемента в виде сульфата кобальта.
Прием препаратов, содержащих кобальт, а также витаминно-минеральных комплексов должен производиться только по рекомендации лечащего врача.
Кобальт играет важную роль в жизнедеятельности человеческого организма, так как входит в состав витамина В12 (в молекуле этого витамина атом кобальта находится в центре). Также этот микроэлемент принимает участие в процессе образования красных кровяных телец, влияет на ферментативные процессы, необходим для нормального гемопоэза (процесса кроветворения). В сформировавшемся организме сконцентрировано примерно 15 мг этого минерального вещества. В основном кобальт концентрируется в печени, селезенке, костной ткани, мышечной ткани и крови.
Роль кобальта в организме человека: вместе с медью и железом участвует в процессе кроветворения, который невозможен без взаимодействия этих трех биоэлементов;регулирует работу нервной системы, за счет того, что входит в состав , а он участвует в строительстве защитного слоя нервной клетки. Предотвращает появление симптомов неврологии и обострения неврологических заболеваний;принимает непосредственное участие в процессе обмена веществ – при условии тесного взаимодействия с другими органическими соединениями выступает в роли активатора реакций обмена;синтез ДНК и РНК не происходит без участия кобаламина (витамина В12), а значит и без кобальта здесь не обойтись;кобаламин участвует в построении и регенерации (восстановлении) клеток костной ткани;многие ферменты активируются именно кобальтом;поджелудочная железа содержит большую половину всего кобальта в организме, а значит он принимает участие в осуществлении главной функции этой железы – выработке инсулина;предупреждает развитие атеросклероза, так как данный микроэлемент может понижать уровень холестерина в крови;в органических соединениях кобальт способствует улучшению иммунных процессов, за счет повышения фагоцитарной активности лейкоцитов (один из механизмов противостояния условно-патогенным микроорганизмам).
Суточная потребность в кобальте: С точной дозой кобальта определиться сложно, так как в разных источниках указаны противоречивые данные. Но в общем можно сказать, что содержание микроэлемента находится в пределах: не менее 8 мкг и не более 200 мкг.
Симптомы недостатка кобальта: общая слабость и быстрая утомляемость; ухудшение памяти; анемия и аритмии; нарушение функций ЦНС (центральной нервной системы); атрофия слизистой желудочно-кишечного тракта; замедляется процесс выздоровления после заболеваний; замедляется общее развитие организма у детей. В общем, нарушается работа всех тех органов, в состав которых входит кобальт и на работу которых влияет.
Симптомы избытка кобальта: Кобальт становится токсичным в количестве от 200 мг до 500 мг, но избыточное поступление этого металла встречается довольно редко. К основным проявлениям избытка относят: бронхиальная астма; гиперплазия (увеличение количество клеток в тканях) щитовидной железы; повышенное артериальное давление; контактный дерматит; поражение сердца; «кобальтовая» пневмония; поражение слухового нерва; увеличение количества липидов и эритроцитов в крови.
В каких продуктах содержится кобальт: Наибольшие количества кобальта обнаружены в бобовых и зерновых культурах, овощах, в мясных (кролик, говядина) и морских продуктах, чае.
Кобальт является жизненно важным микроэлементом, необходимым для нормального функционирования нервной и эндокринной системы, а также процесса кроветворения.
В человеческом организме кобальт в активной форме попадает вместе с (кобаламин), а так же в составе поливитаминов.
Процесс усвоения этого микроэлемента происходит в кишечнике, поэтому у людей с нарушением работы ЖКТ может наблюдаться дефицит этого вещества.
Бром — ядовитый элемент с интересными свойствами
Бром — простое вещество, галоген, открыт в начале 19-го века. Не самый распространенный элемент на Земле, но широко рассеянный: его можно найти в морях и океанах, в озерах и грунтовых водах, в земной коре, атмосфере, в растениях (бобовые, морские водоросли). В чистом виде не встречается из-за своей высокой химической активности. Минералов брома мало и они не имеют промышленного значения. Добывают бром из морской воды, горьких озер, подземных вод, сопутствующих нефтяным месторождениям.
Свойства
Тяжелая жидкость темно-красного цвета. Только бром и ртуть из всех простых веществ в нормальных условиях являются жидкостями. Запах неприятный, именно он дал название веществу (от греческого «бромос», означающего дурной запах). В воде растворяется плохо, хотя и лучше, чем остальные галогены. Смешивается с органическими растворителями в любых пропорциях.
Химически активный элемент, сильный окислитель, образует довольно сильную бромоводородную кислоту HBr. Кроме этого, образует ряд кислородосодержащих кислот. Вступает в реакции с галогенами, неметаллами, металлами. Не реагирует с кислородом, азотом, платиной, танталом. Образует бромиды, легко присоединяется к органическим соединениям.
Следует различать бром, как химический элемент и лекарство «бром», который прописывают в поликлинике в качестве успокаивающего. Бром очень ядовит, а в медицинских целях используется калий бромистый или натрий бромистый, усиливающие процессы торможения в ЦНС.
Бром и его пары ядовиты, при попадании на кожу жидкий бром вызывает долго незаживающие химические ожоги. Работать с реактивом допускается только с использованием всех средств защиты, включая специальную одежду, перчатки и противогаз. Особенно опасно вдыхание паров брома для людей с болезнями органов дыхания, так как может развиться отек легких. При отравлении бромом следует обеспечить человеку свежий воздух или ингаляции кислородом и вызвать врача. Помогает теплое молоко, сода, содосодержащая минеральная вода, кофе. Антидотом и нейтрализатором разливов брома служит раствор тиосульфата натрия. Им можно также пропитывать лицевые повязки для защиты от паров. При небольших разливах подойдет обычная сода, но реакция с бромом экзотермическая, вызывает повышение температуры воздуха и усиливает испарения, так что лучше иметь под рукой тиосульфат натрия.
Применение
— В химической промышленности бром используют для получения органических и неорганических соединений, таких как бромистый калий и натрий, бромоводородная кислота, дибромэтан и многие другие. — Бром востребован для получения резины высокого качества. — Для аналитических целей используют бром, бромную воду, калий бромистый, натрий бромистый. — Бромид серебра применяется в качестве светочувствительного материала в фотографии. — Почти половина производимого брома идет на получение 1,2 дибромэтана, который входит в состав топлива как антидетонационная присадка, применяется для защиты древесины от повреждения насекомыми, в органическом синтезе. — Бром широко используют для получения антипиренов — специальных добавок и пропиток, придающих краскам, пластмассам, древесине, текстильным материалам противопожарные свойства. — Бромхлорметан применяется для наполнения огнетушителей. — Пентафторид брома применяется в ракетном топливе. — В сельском хозяйстве соединения брома используются для борьбы с вредителями растений. — Растворы бромидов применяются в нефтедобыче, на горно-обогатительных комбинатах. — В медицине растворы KBr и NaBr входят в состав успокаивающих средств, например, в состав «корвалола». — Бром может использоваться в качестве дезинфицирующего агента для замены хлора в бассейнах, на станциях водоподготовки.
Калий бромистый, натрий бромистый, бромистоводородная кислота, стандарт-титр калий бромид продаются в нашем интернет магазине по выгодным ценам.
Химическое строение и свойства
Внешние электроны атома имеют конфигурацию 4s24p5. Необходимо отметить, что такое химическое свойство брома, как степень окисления, разнится в зависимости от соединения, к примеру, у гипобромитов этот показатель равен +1, а у броматов он составляет +5.
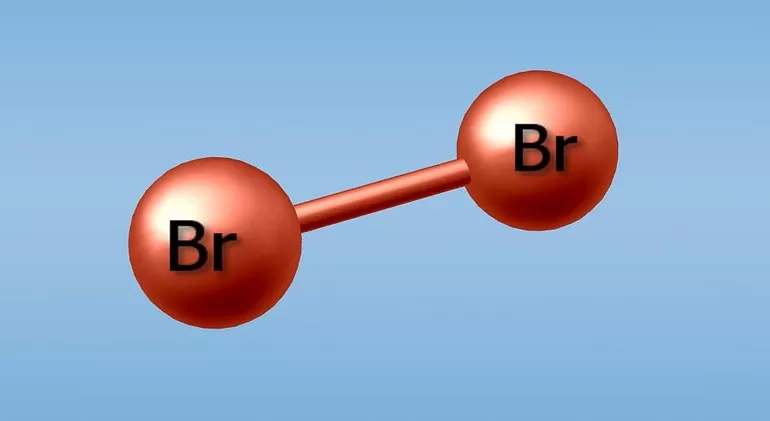
В соединениях валентность брома переменна. Атом вещества имеет заряд только тогда, когда является ионом, заряд ядра атома составляет 35. Представить электронную формулу брома можно следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5. Структурная же формула имеет вид: Br-Br.
Неметалл является химически активным, а потому по способности к реакции располагается между хлором и йодом. Сильное разогревание, иногда сопровождающееся горением, возникает, когда вещество взаимодействует со следующими реагентами:
- сера;
- селен;
- теллур;
- фосфор;
- мышьяк;
- сурьма.
Самыми устойчивыми к такой реакции, даже при высокой температуре и наличии воды, считаются следующие металлы:
- платина;
- свинец;
- серебро;
- тантал.

У золота с бромом взаимодействие проходит довольно активно. Кислород, азот и углерод не создают с элементом прямых соединений даже при повышенной температуре. Чтобы эти вещества соединились, химики применяют различные косвенные методы. К примеру, очень непрочный оксид Вr3О8 получают посредством воздействия озона на бром при 80 °C. Реагировать непосредственно с элементом способны галогены, в результате их взаимодействия образуются BrF3, BrCl и другие соединения.
Бром относится к сильным окислителям. Элемент способен вытеснить из химических соединений йод. Само же вещество подвергается вытеснению хлором и фтором.
Выделить чистый неметалл из бромидов на основе воды можно посредством использования сильных окислителей, поместив все реагенты в кислую среду. Растворяясь в воде, вещество вступает с нею в слабую реакцию, результатом которой становится образование бромистоводородной и бромноватистой кислот. Водный раствор элемента называется бромной водой.
Неметалл растворяется в щелочах:
- При низких температурах соединение брома и гидроксидов даёт бромиды и гипобромиты.
- При температуре около 100 °C получаются бромиды и броматы.
Взаимодействие брома и органических соединений чаще всего проходит с характерным присоединением углерода по двойной связи и замещением водорода. Обычно это происходит при воздействии различных катализаторов или света. Ещё одной распространённой химической реакций является бромирование, суть которого заключается во введении атома реагента в соединение посредством химической реакции вещества с ненасыщенной молекулой или замещения водорода.
Нахождение в природе
Ампула с бромом внутри акрилового куба
Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно. Почти все соединения брома растворимы в воде и поэтому легко выщелачиваются из горных пород. Как примесь он есть в сотнях минералов. Но имеется лишь небольшое количество нерастворимых в воде минералов — галогенидов серебра и меди. Самый известный из них — бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br). Собственных минералов брома мало ещё и потому, что его ионный радиус очень большой и ион брома не может надёжно закрепиться в кристаллической решетке других элементов, вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли. В море сосредоточена большая часть брома. Есть он и в воде солёных озёр, и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
В качестве исходного сырья для производства брома служат:
- морская вода (65 мг/л),
- рассолы соляных озёр,
- щёлок калийных производств,
- подземные воды нефтяных и газовых месторождений.
Атом и молекула брома. Формула брома. Строение атома брома:
Бром (лат. Bromum, от др.-греч. βρῶμος – «дурной запах, зловоние») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Br и атомным номером 35. Расположен в 17-й группе (по старой классификации – главной подгруппе седьмой группы), четвертом периоде периодической системы.
https://youtube.com/watch?v=bHKNPTiMf1Y
Бром – неметалл. Относится к группе галогенов.
Бром обозначается символом Br.
Как простое вещество бром при нормальных условиях представляет собой тяжёлую едкую жидкость красно-бурого цвета с сильным неприятным «тяжёлым» запахом, отдалённо напоминающим запах одновременно йода и хлора. Бром – летучее вещество. Бром является единственным жидким неметаллом при нормальных условиях.
Молекула брома двухатомна.
Химическая формула брома Br2.
Электронная конфигурация атома брома 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5. Потенциал ионизации (первый электрон) атома брома равен 1139,86 кДж/моль (11,81381(6) эВ).
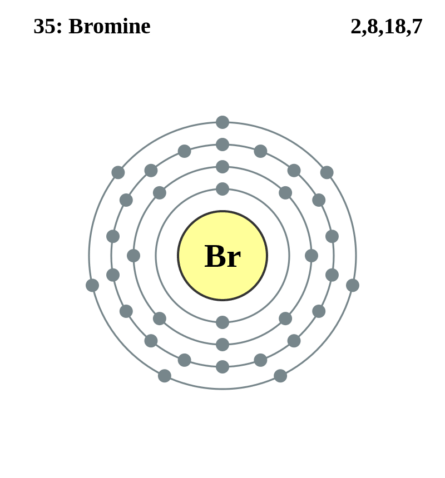
Строение атома брома. Атом брома состоит из положительно заряженного ядра (+35), вокруг которого по четырем оболочкам движутся 35 электронов. При этом 28 электронов находятся на внутреннем уровне, а 7 электронов – на внешнем. Поскольку бром расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома брома на 4s-орбитали находятся два спаренных электрона, на 4p-орбитали – четыре спаренных и один неспаренный электрон. В свою очередь ядро атома брома состоит из 35 протонов и 45 нейтронов. Бром относится к элементам p-семейства.
Радиус атома брома (вычисленный) составляет 94 пм.
Атомная масса атома брома составляет 79,901-79,907 а. е. м.
Бром – химически активный неметалл. Ядовит.
Реакции с простыми веществами
Для элемента характерно взаимодействие со многими неметаллами: серой, фосфором, водородом:
Br2 + H2 = 2HBr
Однако бром непосредственно не реагирует с азотом, углеродом и кислородом. Большинство металлов легко окисляются бромом. Пассивны к действию галогена лишь некоторые из них, например, свинец, серебро и платина. Реакции с бромом более активных галогенов, таких, как фтор и хлор, проходят быстро:
Br2 +3 F2 = 2 BrF3
В последней реакции степень окисления элемента равна +3, он выступает в роли восстановителя. В промышленности бром получают окислением бромоводорода более сильным галогеном, например, хлором. Основными источниками сырья для получения соединения служат подземные буровые воды, а также сильно концентрированный раствор соляных озер. Галоген может взаимодействовать со сложными веществами из класса средних солей. Так, при действии бромной воды, имеющей красно-бурую окраску, на раствор сульфита натрия, мы наблюдаем обесцвечивание раствора. Это происходит по причине окисления бромом средней соли – сульфита до сульфата натрия. Сам же галоген восстанавливается, переходя в вид бромоводорода, не имеющего цвета.

Признаки избытка брома
Если принимать бром внутрь перорально, то первыми под удар попадают элементы нервной системы – головной и спинной мозг. У человека развивается сильная слабость, сонливость, подавляется рефлекторная возбудимость.
При длительном воздействии любых форм вещества возникают следующие признаки интоксикации:
- кожные высыпания;
- проблемы с памятью и когнитивной деятельностью;
- снижается активность щитовидной железы;
- появляется ринит или бронхит;
- нарушается пищеварение.
Бромизм – болезнь, которая развивается при серьёзном воздействии вещества на организм. Для неё характерны совсем другие симптомы:
- возникает анемия и бледность кожи на её фоне;
- снижается вес без видимых причин;
- начинается устойчивая апатия;
- сильно падает либидо, начинаются репродуктивные проблемы у мужчин и женщин;
- появляется тремор;
- в стуле заметны прожилки крови;
- нарушается походка и координация;
- на коже могут появиться узелки и уплотнения, а лимфатические узлы увеличиваются в размерах.
Если человек работает на производстве, связанном с бромом, при появлении любых дискомфортных ощущений он должен обратиться к доктору.
Химические и физические свойства брома
Рассказ о химических и физических свойствах брома предварим описанием его места в периодической таблице химических элементов Менделеева. В ней он располагается под символом Br (от лат. Bromum) под 35-м номером в 17-й группе, где находятся галогены (фтор, хлор, бром, йод и астат). Это неметаллы и активные окислители, не представленные в природе самостоятельно, а только в составе соединений, так как они отличаются высокой химической реактивностью, соединяясь практически со всеми простыми веществами. Есть всего 2 элемента, чьи простые вещества пребывают в жидком виде в нормальных условиях – это ртуть и бром, и всего один жидкий неметалл – бром, представляющий собой красно-бурую, дымящуюся коричневатым паром, ядовитую жидкость. Кристаллизуется бром только при температуре -7,25 °С, а закипает при +59 °С. Растворяется в H2O (получается так называемая бромная вода), но лучше – в органических растворителях.
В чистом виде бром представлен 2-атомной молекулой – Br2, но высокая химическая активность не позволяет ему находиться в природе в свободном состоянии, поэтому он встречается в составе бромидов (соединений с металлами). По содержанию в земных недрах и горных породах он занимает 50-е место, так что его природным источником в большей степени выступают солёные озёра и моря; подземные воды, сопровождающие нефть. Присутствует он и в воздухе, больше – в приморских местностях. Однако при производственной утечке пары брома оказывают отравляющее и удушающее действие на людей.
Свойства брома позволяют широко применять его для производства добавок к топливу, ядохимикатов в сельском хозяйстве, веществ, замедляющих горение, светочувствительного агента бромида серебра в фотоделе, лекарственных препаратов
Работа с этим микроэлементом требует предельной осторожности и соблюдения техники безопасности. Перчатки, спецодежда и противогаз – ваши лучшие союзники при общении с данным веществом
Свойства брома (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Бром |
| 102 | Прежнее название | |
| 103 | Латинское название | Bromum |
| 104 | Английское название | Bromine |
| 105 | Символ | Br |
| 106 | Атомный номер (номер в таблице) | 35 |
| 107 | Тип | Неметалл |
| 108 | Группа | Галоген |
| 109 | Открыт | Карл Якоб Лёвих, Германия, 1825 г., Антуан Жером Балар, Франция, 1826 г. |
| 110 | Год открытия | 1825 г. |
| 111 | Внешний вид и пр. | Красно-бурая жидкость с сильным неприятным, «тяжёлым» запахом. Летуч, ядовит |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0003 % |
| 120 | Содержание в морях и океанах (по массе) | 0,0067 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 7,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | 0,00012 % |
| 124 | Содержание в организме человека (по массе) | 0,00029 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 79,901-79,907 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 |
| 203 | Электронная оболочка |
K2 L8 M18 N7 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 94 пм |
| 205 | Эмпирический радиус атома* | 115 пм |
| 206 | Ковалентный радиус* | 120 пм |
| 207 | Радиус иона (кристаллический) | Br–
182 (6) пм, Br7+ 53 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 185 пм |
| 209 | Электроны, Протоны, Нейтроны | 35 электронов, 35 протонов, 45 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 17-ая группа (по старой классификации – главная подгруппа 7-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0, +1, +3, +4, +5, +7 |
| 302 | Валентность | I, III, V, VII |
| 303 | Электроотрицательность | 2,96 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1139,86 кДж/моль (11,81381(6) эВ) |
| 305 | Электродный потенциал | Br2 + 2e– → 2Br–, Eo = +1,065 В,
Br3– + 2e– → 3Br–, Eo = +1,05 В |
| 306 | Энергия сродства атома к электрону | 324,6 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 3,4 г/см3 (при -7,3 °C и иных стандартных условиях, состояние вещества – твердое тело), 3,1193 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – жидкость), 3,102 г/см3 (при 25 °C и иных стандартных условиях, состояние вещества – жидкость), 3,0848 , г/см3 (при 30 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | -7,2 °C (265,8 K, 19 °F) |
| 403 | Температура кипения* | 58,8 °C (332,0 K, 137,8 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 10,571 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 29,96 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 75,69 Дж/(K·моль) |
| 411 | Молярный объём | 23,5 см³/моль |
| 412 | Теплопроводность | 0,122 Вт/(м·К) (при стандартных условиях),
0,005 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
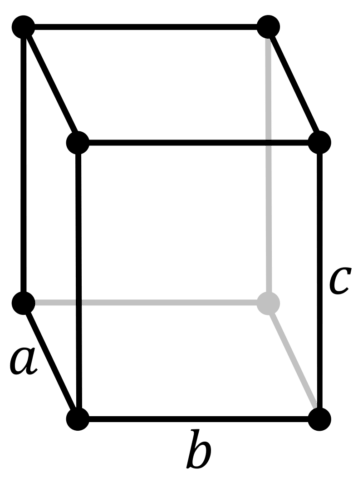
| 512 | Структура решётки |
Орторомбическая
|
| 513 | Параметры решётки | a = 6,67 Å, b = 4,48 Å, c = 8,72 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Cmca |
| 517 | Номер пространственной группы симметрии | 64 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7726-95-6 |
Примечание:
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома брома согласно составляет 120 пм.
206* Ковалентный радиус брома согласно и составляет 120±3 пм и 114 пм соответственно.
402* Температура плавления брома согласно и составляет -7,25 °С (265,9 K, 18,95 °F).
403* Температура кипения брома согласно составляет 58,6 °С (331,9 K, 137,48 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) брома согласно и составляет 10,57 кДж/моль и 9,44 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) брома согласно и составляет 29,56 кДж/моль и 29,5 кДж/моль соответственно.
410* Молярная теплоёмкость брома согласно составляет 75,69 Дж/(K·моль).
дальнейшее чтение
Энциклопедические статьи и книги
- Крист, К. и С. Шнайдер (2020), Бром, Британская энциклопедия.
- Эмерсон, С., и Дж. Хеджес (2011), Химическая океанография и морской цикл углерода, Cambridge University Press, Кембридж.
- Гласов, Р. фон и К. Хьюз (2014), Биогеохимические циклы: бром, Энциклопедия атмосферных наук (второе издание).
- Дж. Найт и Н. Шлагер (2002), Реальная химия, Gale Group, Детройт, Мичиган.
- Миллеро, Ф.Дж. (2013), Химическая океанография, Тейлор и Фрэнсис, Бока-Ратон.
- Newton DE (2010), Бром (пересмотренный), Химические элементы: от углерода до криптона.
- Райли, Дж. П., Дж. Скирроу и Р. Честер (1975), Химическая океанография, Academic Press, Лондон
- Росс, Р. (2017), Факты о броме, LiveScience.
- Стил, Дж. Х., С. А. Торп и К. К. Турекиан (2001), Энциклопедия наук об океане, Academic Press, Сан-Диего.
- Стил, Дж. Х., С. А. Торп и К. К. Турекиан (2009), Энциклопедия наук об океане, Academic Press, Бостон.
- Уоткинс, Т. (2011), Бром, Экологическая энциклопедия.
Рецензируемые журнальные статьи по бромиду (Br — )
- Анбар, А.Д., Й.Л. Юнг, и Ф.П. Чавес (1996), Бромистый метил: источники в океане, поглотители океана и чувствительность климата, журналы AGU.
- Фоти, С.К., и Морская артиллерийская лаборатория White Oak Md (1972), Концентрация ионов бромида в морской воде путем изотопного обмена с бромидом ртути, DTIC.
- Гриббл, GW (2000), Естественное производство броморганических соединений, Науки об окружающей среде и исследованиях загрязнения, 7 (1), 37–49, DOI: 10.1065 / espr199910.002.
- Лери А. (2012), Химия брома в наземных и морских средах, Science Highlight.
- Magazinovic, RS, BC Nicholson, DE Mulcahy, and DE Davey (2004), Уровни бромидов в природных водах: его связь с уровнями хлоридов и общего количества растворенных твердых веществ и последствия для очистки воды, Chemosphere, 57 (4), 329– 335, DOI: 10.1016 / j.chemosphere.2004.04.056.
- Пилинис, К., Д. Б. Кинг и Е. С. Зальцман (1996), Мировой океан: источник или сток бромистого метила ?, Письма о геофизических исследованиях, 23 (8), 817–820, DOI: 10.1029 / 96gl00424.
- Стеммлер, И., И. Хенс и Б. Квак (2015), Морские источники бромоформа в глобальном открытом океане — глобальные закономерности и выбросы, Biogeosciences, 12 (6), 1967–1981, DOI: 10.5194 / bg-12 -1967-2015.
- Сузуки, А., Лим, Л., Хирои, Т., и Такеучи, Т. (20 марта 2006 г.). Быстрое определение бромида в пробах морской воды методом капиллярной ионной хроматографии с использованием колонок из монолитного диоксида кремния, модифицированного ионом цетилтриметиламмония.
Лекарственное и ветеринарное использование
Народная и пасс. Медицина
Бромид лития использовался как успокаивающее средство с начала 1900-х годов. Однако в 1940-х годах он попал в немилость из-за растущей популярности более безопасных и эффективных седативных средств (в частности, барбитуратов ), а также из-за того, что некоторые сердечные пациенты умерли после использования заменителя соли (см. Хлорид лития ). Как карбонат лития и хлорид лития , он был использован в качестве средства для лечения биполярного расстройства .
Бромидные соединения, особенно бромид калия , часто использовались в качестве седативных средств в 19-м и начале 20-го веков. Их использование в безрецептурных седативных средствах и средствах от головной боли (таких как Bromo-Seltzer ) в Соединенных Штатах распространилось до 1975 года, когда бромиды были исключены в качестве ингредиентов из-за хронической токсичности . Это употребление придало слову «бромид» его разговорный оттенок успокаивающего клише .
Говорят, что во время Первой мировой войны британским солдатам давали бромид, чтобы обуздать их сексуальные влечения. Лорд Дансени упоминает солдата, которому давали бромид как успокаивающее средство от нервного истощения и переутомления в своей пьесе « Слава и поэт» (1919).
Бромидные соли используются в гидромассажных ваннах в качестве мягких бактерицидных агентов для образования гипобромита на месте.
Бромид-ион является противоэпилептическим и в виде бромидной соли используется в ветеринарии США. Почки выводят ионы бромида. Период полураспада бромида в организме человека (12 дней) велик по сравнению со многими фармацевтическими препаратами, что затрудняет корректировку дозировки (для достижения равновесия новой дозы может потребоваться несколько месяцев). Концентрация бромид-иона в спинномозговой жидкости составляет около 30% от концентрации в крови и сильно зависит от поступления хлоридов в организм и метаболизма.
Поскольку бромид все еще используется в ветеринарии в Соединенных Штатах, ветеринарные диагностические лаборатории могут регулярно измерять уровень бромида в крови. Однако это не обычный тест в медицине для людей в США, поскольку нет одобренных FDA видов применения бромида. Терапевтические уровни бромида измеряются в европейских странах, таких как Германия , где бромид до сих пор используется терапевтически при эпилепсии человека.