Обмен магния
В организме взрослого человека содержится ок. 20 г М. Половина этого количества сосредоточена в костях, 1/3 — в мышцах, остальное количество содержится в биол, жидкостях, в основном в плазме крови. М., в отличие от кальция, является внутриклеточным элементом, его концентрация в клетке в 3—10 раз превышает его концентрацию во внеклеточной среде. Так, напр., если содержание ионов Mg2+ в плазме крови и экстрацеллюлярной жидкости составляет в среднем ок. 2 мэкв/л, то в интрацеллюлярной жидкости — ок. 26 мэкв/л.
Содержание ионов Mg2+ в плазме крови в норме строго постоянно и у взрослых составляет 1,7—2,8 мг%. Содержание М. в цельной крови выше, т. к. эритроциты содержат приблизительно в 2 раза больше М., чем плазма. Концентрация М. в эритроцитах 3,4—5,8 мг%. По данным Генри (R. J. Henry), с мочой выводится от 1 до 24 мэкв М. в сутки. Основная масса (55—60%) М. содержится в крови в ионизированной форме (растворенный М.), ок. 30% связано с белками, а 10—15% входит в состав комплексных соединений с липидами и нуклеотидами (в основном АТФ и АДФ). Содержание М. в крови у новорожденных детей и кормящих матерей несколько ниже по сравнению с нормой.
Суточная потребность в М. составляет примерно 300 мг и полностью удовлетворяется за счет продуктов питания.
Уменьшение концентрации М. в плазме крови обнаруживается при парентеральном введении большого количества жидкости, не содержащей М. При этом наблюдают изменения в механизме нервно-мышечной передачи, тетанию, протекающую тяжелее, чем при гипокальциемии, появление трофических язв на коже; ухудшение усвоения пищи, вызывающее нарушение процесса роста и снижение температуры тела; распространенное обызвествление тканей, к-рое в первую очередь затрагивает кровеносные сосуды, почки и хрящевую ткань, т. е. явления, сходные с гиперкальциемией, но происходящие при нормальном содержании кальция в организме.
Изменение содержания М. в крови наблюдают при различных патол, состояниях. Так, повышение концентрации М. в крови отмечают при заболеваниях почек с нарушением их выделительной функции, а также при гипотиреозе и диабетическом ацидозе.
Понижение содержания М. в крови имеет место при нарушении всасывания ионов Mg2+ из жел.-киш. тракта (напр., при неукротимой рвоте, поносах), а также при тиреотоксикозе, гиперфункции паращитовидных желез, хрон, алкоголизме, первичном альдостеронизме, почечном ацидозе и при циррозах печени, при эпилепсии, эклампсии и панкреатитах.
Повышение концентрации М. в плазме крови вызывает седативный, в некоторых случаях — наркотический эффект, а также угнетение дыхательного центра.
В обычных условиях различие между токсической дозой М. и его количеством в рационе велико. Толерантность к нему снижается лишь при некоторых заболеваниях почек. Кроме того, всасывание М. в кишечнике затруднено из-за образования его нерастворимых солей. В связи с этим пищевые отравления М. практически не встречаются, за исключением случаев, связанных с нарушением выделительной функции почек. Острые отравления могут возникнуть при введении большого количества солей М. внутривенно (особенно при заболеваниях почек). Хрон, отравления М. могут возникнуть при длительном вдыхании пыли, содержащей соединения М. (напр., магнезитовой пыли, образующейся при производстве магнезитохромовых огнеупорных материалов). В этом случае наблюдается поражение дыхательных путей (так наз. магниевая пневмония).
У людей, работающих в производстве магнийсодержащих металлов и т. п., может развиться хрон, назофарингит, носовые кровотечения, потливость и цианотичность рук, тремор рук, языка, век, появиться выпадение волос, красный дермографизм, повышение сухожильных рефлексов, увеличение концентрации М. в крови. Иногда наблюдаются также жел.-киш. заболевания. Выздоровление наступает после прекращения работы со сплавом, содержащим Mg.
Вдыхание 4—6 мг/м3 окиси М. в течение 12 мин. вызывает явления, напоминающие литейную лихорадку (см.), но протекающую легче и обнаруживающуюся раньше.
Меры предупреждения отравления окисью М.: промышленные респираторы, герметизация производственных процессов и т. п.
Магниевые «нобели»: хлорофилл
Следующий наш рассказ о нобелевских премиях, связанных с магнием, будет посвящен Рихарду Вильштеттеру, ученику Адольфа фон Байера, изучавшего красители.
Рихард Вильштеттер
В год, когда его патрон удостоился Нобелевской премии по химии (1905), он перешел на полную профессорскую ставку в Цюрих, в знаменитый ETH, и начал работать на производстве красителя хлорофилла — вещества, которое делает листья зелеными и который обеспечивает превращение углекислого раза растениями в углеводы (процесс фотосинтеза).
Именно на поприще изучения хлорофилла (до Вильштеттера вообще никто не знал даже брутто-формулы этого важнейшего вещества) он добился наибольших успехов. Сначала он выявил эмпирическую формулу хлорофилла — относительное содержание в нем атомов углерода, азота, водорода, кислорода и магния.
Вильштеттеру удалось опровергнуть утверждение о том, что у каждого растения — свой хлорофилл. Химик вместе со своим учеником Артуром Штоллем показал, что во всем растительном царстве существуют всего две очень близкие формы хлорофилла: a и b (правда, потом нашлись и c1, и c2, и некоторые другие).
Хлорофилл C1 и C2
Постепенно Вильштеттер начал расшифровывать структуру пигмента и обнаружил в нем тетрапиррольное кольцо (порфирин) с центральным атомом магния. Нужно отметить, что сырьем «хлорофилловой фабрики» Вильштеттера стала крапива, ведь в ней содержится очень много хлорофилла.
«Цель моей работы состояла в том, чтобы установить структурные характеристики наиболее широко распространенных пигментов растений, в частности хлорофилла, и найти определенные критерии, касающиеся их химической функции», — так описал свой труд Рихард Вильштеттер в нобелевской лекции.Это была первая премия «за хлорофилл». Но далеко не последняя.
В 1930 году Нобелевскую премию по химии с формулировкой «За исследования по конструированию гемина и хлорофилла, особенно за синтез гемина» получил немец Ханс Фишер, который сделал первые шаги по синтезу хлорофилла.
На представлении лауреата Ханс Седербаум из Шведской королевской академии сказал: «Работы Фишера стали научным достижением, которое вряд ли могло бы быть получено предыдущими поколениями. Исследования Фишера показали, что природа, несмотря на ее непомерное многообразие, довольно экономно использует стандартный строительный материал для конструирования таких сильно различающихся как по внешнему виду, так и по распространению двух веществ, ».
Ханс Фишер
Дальше – больше. Как вы думаете, кто сделал первый в истории направленный синтез хлорофилла? Можно даже не гадать, «второй по крутизне химик после природы» (цитируя представителя Нобелевского комитета) – Роберт Бернс Вудворд,который опубликовал очередной рутинный великий синтез в 1960 году. Так что и этот синтез стал кирпичиком в нобелевской премии великого Вудворда, получившего премию «потому, что он молодец».
Американский биохимик Мелвин Кальвин при помощи радиоактивного углерода сумел показать, как именно работает хлорофилл в растениях. Как итог – Нобелевская премия по химии 1961 году «За исследование усвоения двуокиси углерода растениями». И, наконец, отчасти с хлорофиллом связана Нобелевская премия по химии 1988 года, которую получили немцы Иоганн Дайзенхофер, Хармут Михель и Роберт Хубер, которые установили трёхмерную структуру фотосинтетического реакционного центра.
Но, конечно, магний важен для человека не только Нобелевскими премиями. Магний – одиннадцатый по распространенности в нашем организме элемент, при этом он входит в состав или участвует в работе почти 300 ферментов (это из известных!), так что этот элемент нам просто необходим.
А в завершение нашего длинного рассказа мы покажем вам видео из знаменитой серии популярных видеороликов о химических элементах серии «Периодическое видео химических элементов», которую ведет замечательный профессор Ноттингемского университета Мартин Полякофф
https://youtube.com/watch?v=FKkWdizutxI
Текст: Алексей Паевский
Где используется
Некогда самым известным применением металла был фотоаппарат с магниевой вспышкой. Сегодня свойства и характеристики вещества сделали его незаменимым или важным для многих отраслей. Используется магний металлический, в соединениях и сплавах.
Магниевые сплавы
Промышленный комплекс
Ковкий, пластичный, легкий магний относится к металлам, незаменимым в металлургии и машиностроении:
- Огнеупорные материалы – исходник для выработки компонентов металлургических печей (оксид магния).
- Сырье для получения надежных лёгких и сверхлегких сплавов. Их забирают ракето-, авиастроение, автопром.
- Инновационный материал, созданный в конце XX века, – ферросиликомагний (магний + кремний + железо). Из этого сплава выплавляют чугун: высокопрочный и с «червячной» конфигурацией графита. Это своеобразный гибрид чугуна и стали, материал нового поколения для нужд машиностроения.
Закупаются светошумовые боеприпасы (зажигательные бомбы, сигнальные ракеты, трассирующие пули).
Другие отрасли
Магний используется для нужд науки и других отраслей:
- Привычным атрибутом стали энергоемкие резервные электрические батареи, сухие элементы на основе металла, его соединений (бромид, перхлорат).
- Выращенные кристаллы фторида магния – компонент при изготовлении линз, другой оптики.
- Перхлоратом металла лаборанты осушают газы.
- Бромид металла служит электролитом химических источников тока.
Медициной востребованы соединения вещества. Кардиологи, неврологи, гастроэнтерологи выписывают своим пациентам сульфат/цитрат магния, аспаркам, другие препараты.
Перспективы
Ученые трудятся над созданием магниево-серных батарей. По расчетам, они эффективнее ионно-литиевых аккумуляторов по емкости.
Как увеличить процент усвоения магния
Зная суточную потребность в магнии и калорийность продуктов, сформировать сбалансированное меню не составит труда. Увеличить процент усвоения полезного элемента помогут несколько советов.
Соблюдение баланса кальция и магния (2:1)
Употреблять продукты, богатые кальцием и магнием, необходимо в балансе, поскольку большой объем кальция при дефиците магния загрязняет организм. Дисбаланс способствует:
- отложению кальция в суставах из-за не усвоения;
- образованию камней в почках.
Именно поэтому важно контролировать поступление магния и кальция с пищей
Нейтрализация фитиновой кислоты
Фитиновая кислота связывает железо, кальций и магний, что препятствует усвоению полезных микроэлементов. Кислота содержится в привычных повседневных продуктах питания:
- цельнозерновые злаковые культуры;
- бобовые;
- мука, мучные изделия;
- орехи.
Чтобы снизить объем фитиновой кислоты необходимо замачивать бобовые, крупы, орехи хотя бы на 8 часов. При этом, в крупу рекомендуется добавить несколько капель лимонного сока, а в бобовые – морскую соль.
Важность витамина в6
Сочетая продукты, богатые магнием и витамином B6, выведение микроэлементов замедляется. Перечень компонентов с концентрацией B6 в порядке убывания:
|
Наименование |
В6 (мг) |
|
Рисовые отруби |
4,07 |
|
Шалфей |
2,69 |
|
Мята сушеная |
2,57 |
|
Эстрагон сушеный |
2,41 |
|
Фисташки (сырые) |
1,70 |
|
Семечки (сырые) |
1,34 |
|
Пшеничные отруби |
1,30 |
|
Чеснок |
1,23 |
|
Фундук |
0,56 |
|
Грецкий орех |
0,53 |
|
Фасоль |
0,52 |
|
Семена льна |
0,47 |
|
Кешью |
0,41 |
|
Финики |
0,24 |
Разрушение витамина B6 происходит во время заморозки продуктов питания, консервации и в процессе термической обработки (способ приготовления с помощью высокой температуры).
Взаимосвязь магния и витамина D
При профилактике остеопороза и переломах костей необходимо обеспечить организм всеми необходимыми микроэлементами. Увеличить усвоение витамина D на 50% поможет именно магний.
Влияние вредных привычек на усвоение
Согласно медицинским исследованием, всего 30% магния из продуктов питания усваивается организмом. Вредные привычки, которые выводят микроэлемент:
- употребление алкоголя;
- кофеин.
Обилие в рационе быстрых углеводов, трансжиров, переработанной пищи также приводит к дефициту магния.
Свойства магния (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Магний |
| 102 | Прежнее название | |
| 103 | Латинское название | Magnesium |
| 104 | Английское название | Magnesium |
| 105 | Символ | Mg |
| 106 | Атомный номер (номер в таблице) | 12 |
| 107 | Тип | Металл |
| 108 | Группа | Цветной, щёлочноземельный металл |
| 109 | Открыт | Джозеф Блэк, Шотландия, 1755 г., Хемфри Дэви, Великобритания, 1808 г., Антуан Александр Брутус Бюсси, Франция, 1829 г. |
| 110 | Год открытия | 1755 г. |
| 111 | Внешний вид и пр. | Лёгкий, ковкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 2,9 % |
| 120 | Содержание в морях и океанах (по массе) | 0,13 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,06 % |
| 122 | Содержание в Солнце (по массе) | 0,07 % |
| 123 | Содержание в метеоритах (по массе) | 12 % |
| 124 | Содержание в организме человека (по массе) | 0,027 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 24,304-24,307 а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 |
| 203 | Электронная оболочка |
K2 L8 M2 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 145 пм |
| 205 | Эмпирический радиус атома* | 150 пм |
| 206 | Ковалентный радиус* | 141 пм |
| 207 | Радиус иона (кристаллический) | Mg2+
71 (4) пм, 86 (6) пм, 103 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 173 пм |
| 209 | Электроны, Протоны, Нейтроны | 12 электронов, 12 протонов, 12 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 2-ая группа (по старой классификации – главная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0; +1; +2 |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 1,31 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 737,75 кДж/моль (7,646236(4) эВ) |
| 305 | Электродный потенциал | Mg2+ + 2e– → Mg, Eo = -2,363 В |
| 306 | Энергия сродства атома к электрону | 50 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 1,738 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело),
1,584 г/см3 (при температуре плавления 650 °C и иных стандартных условиях, состояние вещества – жидкость), 1,57 г/см3 (при 651 °C и иных стандартных условиях, состояние вещества –жидкость) |
| 402 | Температура плавления | 650 °C (923 K, 1202 °F) |
| 403 | Температура кипения | 1090 °C (1363 K, 1994 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 8,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 128 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,983 Дж/г·K (при 25 °C), 1,6 Дж/г·K (при 100 °C), 1,31 Дж/г·K (при 650 °C) |
| 410 | Молярная теплоёмкость* | 24,869 Дж/(K·моль) |
| 411 | Молярный объём | 14,0 см³/моль |
| 412 | Теплопроводность | 156 Вт/(м·К) (при стандартных условиях),
156 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки |
Гексагональная плотноупакованная |
| 513 | Параметры решётки | a = 3,2029 Å, c = 5,2000 Å |
| 514 | Отношение c/a | 1,624 |
| 515 | Температура Дебая | 318 К |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-95-4 |
Примечание:
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома магния согласно составляет 160 пм.
206* Ковалентный радиус магния согласно и составляет 141±7 пм и 136 пм соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) магния согласно составляет 9,20 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) магния согласно составляет 131,8 кДж/моль.
410* Молярная теплоемкость магния согласно составляет 24,90 Дж/(K·моль).
Польза и вред добавок
Чистый магний ковкий, легкий металл. Только есть у металла свойство — подверженность коррозии. Потому чистый металл используют редко, в отличие от его сплавов. Для сплавов магния очень важны добавки алюминия, циркония, цинка.
Алюминий делает сплав прочнее и удобнее для литейных работ.
Количество лигатуры важно для качеств сплава:
- 3% алюминия придадут наибольшую пластичность;
- 6% лигатуры — даст лучшие прочность и пластичность;
- 9% алюминия подарит сплаву максимальную прочность.
Свойства цинка в сплавах подобны алюминиевым:
- 3% добавка максимально увеличивает пластичность;
- 5% цинка даст гармоничное сочетание пластичности и прочности сплава;
Если в сплаве есть вредные примеси (никель, железо), то лигатура цинка повысит коррозионную стойкость.
Кремний повысит способность к литью, но в присутствии железа уменьшит устойчивость к ржавчине.
Никель и железо примеси вредные, они делают сплав подверженным ржавчине.
Сплавы магния делят на деформируемые (МА) и литейные (МЛ); последние применяются значительно чаще. В сплав МЦИ добавляют медь, железо, цинк, никель. Эта смесь металлов хороша при вибронагрузках.
Получение магния
В промышленности практикуют две технологии получения этого металла:
- электролитическую;
- термическую обработку сырья.
Первый вариант требует смешивания в электролитической ванне обезвоженных хлоридов натрия, магния и калия. При расплаве магний восстанавливается. Полученный металл сливают, ванну наполняют снова сырьевой смесью. На выходе магний имеет в своем составе около 2% примеси. При необходимости его несложно дополнительно очистить, добившись почти идеального показателя. Очищают магний сразу, пока он не остыл.
Получение магния вторым методом предполагает использование в качестве исходного материала доломита или соленой (озерной либо морской) воды. Доломит потребуется перемешать с коксом, разогреть до рабочей температуры не менее 2100 градусов. В технологической установке предусмотрено отведение и конденсация магниевых паров.
Магний в организмах
Магний содержится во всех растениях и животных. Вещество концентрируется в некоторых морских организмах. Максимальное количество металлического элемента содержится в известковых губках — до 4%.
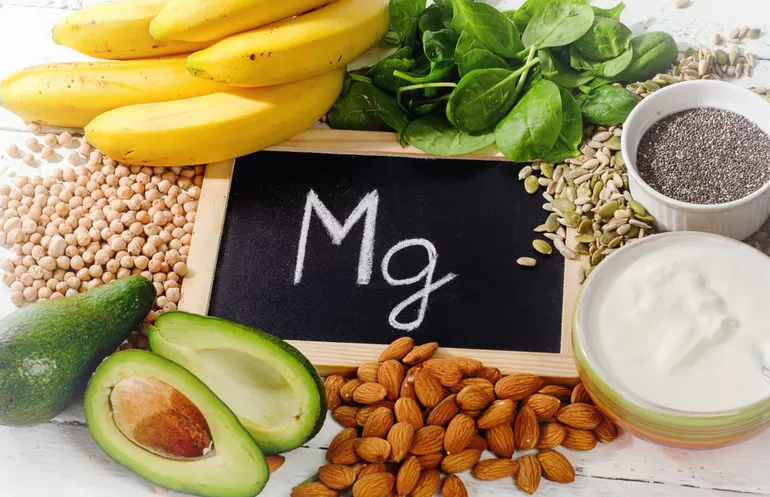
Входит этот реагент и в состав хлорофилла зелёных растений. В общей сложности на их долю приходится 100 миллиардов тонн вещества. Учёные обнаружили магний во всех компонентах, необходимых клеткам живых организмов для существования. Этот элемент запускает многие ферменты и позволяет хромосомам и коллоидным системам растений сохранять стабильность. Кроме того, реагент поддерживает в клетках тургорное давление. Благодаря магнию растения лучше поглощают и усваивают находящийся в земле фосфор.
Люди и животные получают металлический элемент с пищей. Суточная норма потребления для человека составляет от 0,3 до 0,5 г. У детей и беременных женщин потребность в веществе несколько выше. У здорового человека в крови должно содержаться около 4,3 мг/% магния. В организме основным потребителем реагента является печень, но большая часть поглощённого ею металла постепенно переходит в кости и мышцы.
Взаимодействие с различными кислотами
Для краткости, проще рассмотреть несколько экспериментов. Для них берутся такие виды кислот:
- Соляная.
- Азотная.
- Серная (разбавленная и нет).
В первом случае наблюдается практически мгновенное растворение, сопровождающееся пузырьками белых газов и резким запахом хлора. Емкость, в которой происходила реакция нагревается.
В азотной кислоте кусочек магния не тонет. Бурый газ скапливается над поверхностью жидкости, выделяется тепло. Иногда говорят, что кислота «кипела», окружая кусочки магния.
Третий случай необходимо рассматривать, как два частных. В неразбавленной серной кислоте реакция идет медленно. Если же использовать раствор с небольшим количеством воды, магний также, как с азотной кислотой плавает на поверхности. При этом происходит едва заметная реакция с выделением белых пузырьков газа.
Нахождение в природе[править | править код]
Кларк магния — 1,98 % (19,5 кг/т). Это один из самых распространённых элементов земной коры. Большие количества магния находятся в морской воде в виде раствора солей. Основные минералы с высоким массовым содержанием магния:
- морская вода — (0,12—0,13 %),
- карналлит — MgCl2 • KCl • 6H2O (8,7 %),
- бишофит — MgCl2 • 6H2O (11,9 %),
- кизерит — MgSO4 • H2O (17,6 %),
- эпсомит — MgSO4 • 7H2O (9,9 %),
- каинит — KCl • MgSO4 • 3H2O (9,8 %),
- магнезит — MgCO3 (28,7 %),
- доломит — CaCO3·MgCO3 (13,1 %),
- брусит — Mg(OH)2 (41,6 %).
Магнезиальные соли встречаются в больших количествах в солевых отложениях самосадочных озёр. Месторождения карналлита осадочного происхождения имеются во многих странах.
Магнезит образуется преимущественно в гидротермальных условиях и относящихся к среднетемпературным гидротермальным месторождениям. Доломит также является важным магниевым сырьём. Месторождения доломита широко распространены, запасы их огромны. Они генетически связаны с карбонатными осадочными слоями и большинство из них имеет докембрийский или пермский геологический возраст. Доломитовые залежи образуются осадочным путём, но могут возникать также при воздействии на известняки гидротермальных растворов, подземных или поверхностных вод.
Чрезвычайно редким минералом является самородный магний, образующийся в потоках восстановительных газов и впервые обнаруженный в 1991 году в береговых отложениях Чоны (Восточная Сибирь), а затем в лавах в Южном Гиссаре (Таджикистан).
Природные источники магнияправить | править код
- Ископаемые минеральные отложения (магнезиальные и калийно-магнезиальные карбонаты: доломит, магнезит).
- Морская вода.
- Рассолы (рапа соляных озёр).
В 1995 г. бо́льшая часть мирового производства магния была сосредоточена в США (43 %), странах СНГ (26 %) и Норвегии (17 %), на рынке возрастает доля Китая.
Переизбыток и недостаток
Магний практически безвреден для организма, хотя некоторым его соединениям и присвоен II класс опасности. В основном же металл в разных видах приносит лишь пользу. А страдают люди, животные и растения чаще всего от недостатка или переизбытка вещества.
Когда металла в организме слишком мало, увеличивается риск развития сахарного диабета, болезней почек и кишечника. У людей, страдающих от недостатка микроэлемента, часто болит голова, начинается бессонница, появляются спазмы мышц, быстро наступает утомление. При отсутствии лечения это может привести к различным более серьёзным заболеваниям, повышается возможность заболеть раком.
Прежде чем приступать к восстановлению уровня вещества в организме, необходимо проконсультироваться с врачом и установить степень потребности в веществе. После сдачи анализов доктор назначит переменный или постоянный на протяжении какого-то времени приём соответствующих лекарственных препаратов, принимать которые следует строго по инструкции.
При переизбытке микроэлемента у людей появляются следующие болезни:
- артрит;
- нарушение речи;
- тошнота;
- сонливость;
- и так далее.
Магний относится к жизненно необходимым микроэлементам. Сложно переоценить роль этого вещества в животных и растительных организмах. Его отсутствие в достаточном количестве способно возбудить множество заболеваний.
Австралийская сборка
MGB собирали в Австралии с 1963 по 1972 год, за это время было продано около 9000 экземпляров. Машины были собраны из полных комплектов для разборки, доставленных из Англии. Первоначально сборка была предпринята прессованных корпорации Metal на своем Enfield объекте, но впоследствии был перенесен в ВМС Австралии «s Зетленд завода в 1968 году австралийской сборки закончилась в 1972 году , когда правительство выпустило требование о том, чтобы пользоваться благоприятным тарифным лечения, местного производства автомобили должны иметь 85% местного содержания. В то время местное содержание собранных в Австралии МГБ оценивалось всего в 45%. Все МГБ австралийской сборки были родстерами.
Дефицит и избыток
Сбалансированный рацион питания, в 80 % случаев, покрывает дневную потребность организма в магнии. Однако, ввиду промышленной обработки сырья (рафинации, очистки, размола, пастеризации) концентрация минерала в еде снижается вдвое. Кроме того, многие люди не дополучают его в должном объёме, поскольку ведут нездоровый образ жизни или имеют хронические патологии пищеварительного тракта.
Учитывая, что магний – кофактор ферментов и регулятор биохимических реакций в организме, его дефицит снижает иммунитет и вызывает функциональные расстройства.
Признаки магниевой недостаточности:
- учащение инфекционных заболеваний;
- постоянная усталость;
- затяжные сезонные депрессии;
- снижение работоспособности;
- продолжительный период выздоровления;
- тревожность, фобии, беспокойства;
- бессонница, утренняя усталость;
- раздражительность;
- блики перед глазами;
- мышечные спазмы, подёргивания, судороги;
- чувствительность к шуму и смене погоды;
- головокружение;
- нарушение координации движений;
- перепады артериального давления;
- нарушения сердечного ритма;
- спастические боли в животе, сопровождающиеся диареей;
- выпадение волос, ломкость ногтевых пластин.
Помимо этого, характерным симптомом гипомагниемии, по мнению учёных Н.М. Назаровой, В.Н. Прилепской, Е.А. Межевитиновой, является предменструальный синдром, вызванный снижением количества эритроцитов в крови.
Экзогенные факторы, провоцирующие нехватку минерала в организме:
- соблюдение “жёстких” монодиет, голодание;
- недостаточное содержание магния в ежедневном меню;
- чрезмерное употребление кальциевой, белковой и липидной пищи;
- хронический алкоголизм, табакокурение;
- гормональная контрацепция;
- приём, обеднённых магнием, смесей для парентерального или энтерального питания;
- недостаточность витаминов В1, В2, В6 в рационе.
Однако, практически всегда гипомагниемия возникает на фоне патологий внутренних органов.
Эндогенные причины магниевой недостаточности:
- нарушение всасывания нутриента вследствие диареи или тонкокишечных свищей;
- заболевания почек;
- сахарный диабет со стабильно высоким уровнем сахара в крови;
- инфаркт миокарда;
- гиперфункция щитовидной и паращитовидной желёз:
- недостаточность кровообращения, особенно застойная;
- цирроз печени;
- повышенный синтез альдостерона (гормона надпочечников).
Помимо этого, продолжительный приём мочегонных средств, глюкокортикостероидов, цитостатических препаратов и эстрогенов чреват развитием гипомагниемии.
Помните, дефицит макроэлемента сложно диагностировать по анализу крови, поскольку 99 % нутриента сосредоточено внутри клеточных структур, а только 1 % ? В плазме крови. Ввиду этого, анамнез устанавливают по симптоматике, предварительно оценив клиническое состояние пациента.
Передозировка магния, в 90 % случаев, развивается на фоне почечной недостаточности, повышенного катаболизма белков, нелеченого диабетического ацидоза, неконтролируемого употребления препаратов, продуктов питания, содержащих микроэлемент.
Симптомы гипермагниемии:
- нарушение речи, координации;
- сонливость;
- замедление пульса;
- заторможенность;
- снижение частоты сердечных сокращений (брадикардия);
- сухость слизистых оболочек;
- боль в животе;
- тошнота, рвота, понос.
Продолжительная гипермагниемия чревата стойким понижением артериального давления, нарушением дыхания, а в редких случаях, остановкой сердца.
Общие данные
Расположение в периодической таблице Д.И. Менделеева: в старой версии — III период, III ряд, II группа, в новой версии таблицы – 2 группа, 3 период.
- Атомный номер – 12
- Атомная масса – 24,3050
- Электронная конфигурация – 3s2
- Температура плавления (°С) – 650
- Температура кипения (°С) – 1090
- CAS: 7439-95-4
Физико-химические свойства. Магний представляет собой мягкий металл серебристо-белого цвета, с металлическим блеском, покрытый достаточно прочной плёнкой в виде оксида магния (MgO). Хорошо поддается прессу или обрезанию. При нагревании защитная пленка MgO разрушается и металл начинает гореть сверхъярким белым пламенем, способным обжечь сетчатку глаза при рассматривании без защитных средств). При горении образовывается оксид, и небольшая порция нитрида магния (Mg3N2).
При попадании воды на сильно раскаленный металл происходит сильная реакция, поэтому его нельзя тушить водой. При контакте с щелочами реакции нет, однако при взаимодействии с кислотой растворяется, бурно выделяя при этом большое количество водорода.
Взрывоопасен даже в составе порошком при контакте с перманганатом калия и другими сильными окислителями.
Сила тяжести
Сила тяжести — сила, с которой Земля притягивает все тела.
|
Сила тяжести F = mg F — сила тяжести m — масса тела g — ускорение свободного падения [м/с2] На планете Земля g = 9,8 м/с2 |
На первый взгляд сила тяжести очень похожа на вес тела. Действительно, в состоянии покоя на поверхности Земли формулы силы тяжести и веса идентичны. Но разница все-таки есть, давайте разбираться.
Эта формула и правда аналогична силе тяжести. Вес тела в состоянии покоя численно равен массе тела, разница состоит лишь в точке приложения силы.
Сила тяжести — это сила, с которой Земля действует на тело, а вес — сила, с которой тело действует на опору. Это значит, что у них будут разные точки приложения: у силы тяжести к центру масс тела, а у веса — к опоре.
Также, важно понимать, что сила тяжести зависит исключительно от массы и планеты, на которой тело находится. Вес зависит также от ускорения, с которым движутся тело или опора
Например, в лифте вес тела зависит от того, куда и с каким ускорением движется тело. А силе тяжести все равно, куда и что движется — она не зависит от внешних факторов.
На второй взгляд сила тяжести очень похожа на силу тяготения. В обоих случаях мы имеем дело с притяжением — значит можем сказать, что это одно и то же. Практически.
Мы можем сказать, что это одно и то же, если речь идет о Земле и каком-то предмете, который к этой планете притягивается. Тогда мы можем даже приравнять эти силы и выразить формулу для ускорения свободного падения.
F = mg
F = GMm/R2
Приравниваем правые части:
mg = GMm/R2
Делим на массу левую и правую части:
g = GM/R2
Это и будет формула ускорения свободного падения. Ускорение свободного падения для каждой планеты уникально, эта формула нужна.
|
Формула для ускорения свободного падения g = GM/R2 F — сила тяготения M — масса планеты R — расстояние между телами G — гравитационная постоянная G = 6.67 × 10-11 м3 кг-1 с-2 |
А теперь задачка
Определить силу тяжести, действующую на тело массой 80 кг.
Решение:
Не смотря на кажущуюся простоту, тут есть над чем подумать.Вроде бы просто нужно взять формулу F = mg, подставить числа и дело в шляпе.
Да, но есть один нюанс: в значении ускорения свободного падения для Земли очень много знаков после запятой. В школе обычно дают то же значения, что мы указывали выше: g = 9,8 м/с2.
В экзаменах ОГЭ и ЕГЭ в справочных данных дают g = 10 м/с2.
И кому же верить?
Все просто: для кого решается задача, тот и главный. В экзаменах берем g = 10 , в школе при решении задач (если в условии задачи не написано что-то другое) берем g = 9,8 м/с2.
Итак, F = mg.
F = 80*10 = 800 Н
Ответ: 800 Н.
Источники[править | править код]
- ↑ (англ.). WebElements. Дата обращения: 15 августа 2013.
- Химическая энциклопедия : в 5 т / редкол.: Кнунянц И. Л. (гл. ред.). — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 621. — 671 с. — 100 000 экз.
- Новгородова М. И. Обнаружен самородный магний? // Природа. — 1991. — № 1. — С. 32—33.
- Новгородова М. И. Самородный магний и проблема его генезиса // Геохимия. — 1996. — № 1. — С. 41—50.
- Елена Савинкина. . Энциклопедия Кругосвет. Дата обращения: 8 сентября 2012.
- . vestnik.uapa.ru. Дата обращения: 24 июля 2019.
- (недоступная ссылка). Дата обращения: 12 сентября 2018.
- ↑ Нечаев А. П., Траубенберг С. Е., Кочеткова А. А. и др. Пищевая химия : ; под ред. А. П. Нечаева. — Изд. 4-е, испр. и доп. — СПб. : ГИОРД, 2007. — 635 с. — 1000 экз. — ISBN 5-98879-011-9.
- . (02.09.2019). — информация о препарате «магне В6». Дата обращения: 4 октября 2019.
Формы выпуска
Высокая степень активности магния не позволяет принимать его в чистом виде. Чтобы получить стабильную форму, Mg связывают другими элементами. Он входит в состав многих препаратов, отличающихся содержанием чистого вещества, степенью усвояемости организмом (биодоступностью), лекарственной формой:
- таурат магния в качестве дополнительного компонента содержит аминокислоту таурин, способствует снятию усталости, нормализует метаболизм, нервные и мышечные функции, рекомендуется для людей, имеющих проблемы с сердцем и давлением;
- стеарат магния включает стеариновую кислоту, используется для наполнения и поверхностной обработки некоторых лекарственных форм, например, вагинальных таблеток;
- цитрат магния является солью лимонной кислоты, наиболее известен БАД компании Солгар, используемый от мигреней и как антистрессовый препарат;
- магния лактат – минеральная добавка, соль молочной кислоты;
- глицинат магния – соль глицина, обладающего тормозящим эффектом, больше всего подходит в качестве успокаивающего средства;
- оротат магния – соль оротовой кислоты, рекомендована страдающим сердечно-сосудистыми заболеваниями, в частности, перенесшим инфаркт;
- сульфат магния – соль серной кислоты, при приеме внутрь оказывает сильное слабительное действие, часто употребляется наружно, например, для расслабляющих ванн;
- малат магния – соль яблочной кислоты, снимает усталость и боль в мышцах;
- хелатный магний – содержит мало Mg, но быстрее всего усваивается организмом, так как биодоступность находится на уровне 90-95%;
- L-треонат магния – соль треоновой кислоты, на рынке появилась недавно, улучшает сон и память.
Важно! Нитрат магния – эффективное удобрение, а не лекарственная форма. Формы магния и их усвояемость
Формы магния и их усвояемость
Содержание Mg в препарате мало что может сказать далекому от фармации человеку. В лекарстве может быть много действующего вещества, но, если оно находится в плохо доступной форме, усвоится только малая часть, остальное выведется из организма. Именно к таким препаратам относится оксид магния. Плохо усваивается и микроэлемент, содержащийся в солях серной кислоты.
В чистом виде Mg вообще имеет низкую степень абсорбции – не более 45%. Но чем больше нуждается в магнии организм, тем лучше он усваивается. Независимо от формы. Если нужен магний, какой лучше усваивается, выбирать следует между цитратом и хелатом. Некоторые источники советуют добавить к списку лактат и глицинат.






