Продукты, которых следует избегать
| Мясо | Сильное окисляющее воздействие |
| Рыба | Сильное окисляющее воздействие |
| Сало | Среднее окисляющее воздействие |
| Яйца | Сильное окисляющее воздействие |
| Морепродукты (устрицы, ракообразные, мидии, креветки, др.) | Сильное окисляющее воздействие |
| Твёрдый сыр | Среднее окисляющее воздействие |
| Мягкий сыр | Слабое окисляющее воздействие |
| Сметана, сливки, сливочное масло | Среднее окисляющее воздействие |
| Мёд магазинный или несвежий | Среднее окисляющее воздействие |
| Пастеризованное молоко | Среднее окисляющее воздействие |
| Алкоголь | Сильное окисляющее воздействие |
| Кофе | Сильное окисляющее воздействие |
| Какао | Среднее окисляющее воздействие |
| Чёрный чай | Среднее окисляющее воздействие |
| Рафинированный сахар и сладости, его содержащие | Сильное окисляющее воздействие |
| Магазинные соки (чаще всего содержат консерванты и сахар) | Сильное окисляющее воздействие |
| Крупы (за исключением гречки и проса) | Среднее/слабое окисляющее воздействие |
| Дрожжевые мучные изделия | Среднее окисляющее воздействие |
| Арахис | Сильное окисляющее воздействие |
| Грецкий орех | Сильное окисляющее воздействие |
| Кешью | Среднее окисляющее воздействие |
| Семечки, подсолнечное масло | Слабое окисляющее воздействие |
| Овощи тушёные, варёные | Среднее/слабое окисляющее воздействие |
| Овощи жареные | Сильное окисляющее воздействие |
| Варенье | Сильное окисляющее воздействие |
| Фрукты неспелые | Среднее окисляющее воздействие |
| Бобовые сушёные (горох, нут, чечевица, фасоль, др.) | Среднее окисляющее воздействие |
Существует много спорной информации относительно того, какой продукт закисляет, а какой ощелачивает. Более-менее единое мнение есть только относительно мясной пищи, яиц, рыбы, алкоголя, кофе, сахара и рафинированных продуктов. Включая в рацион этот список, вы понижаете уровень Ph своего организма. Да и о вреде этих продуктов, помимо влияния на кислотно-щелочной баланс, достаточно много другой информации.
Список продуктов с самым высоким показателем pH.
Существует множество щелочных продуктов, но все они обладают разным уровнем pH. Самыми высокими показателями обладают:
- Лимон.
- Зелень.
- Корнеплоды.
- Капуста.
- Брокколи.
- Авокадо.
- Огурец.
- Сельдерей.
- Пророщенная пшеница.
- Морская капуста.
- Травяной чай.
Лимон для здоровья и похудения.
В чем суть закисления?
Сторонники данной теории утверждают, что закисление организма приводит к остеопорозу, раку, снижению иммунитета и всевозможным воспалительным процессам. Закислению организма способствует употребление кислых продуктов. Перечень разнится от источника к источнику, но в целом выглядит примерно так:
- красное мясо (в меньшей степени — белое мясо, яйца и рыба);
- сахар, сахарозаменители и все, что их содержит;
- какао и его производные;
- кофеин;
- молочные продукты;
- зерновые крупы;
- мучные изделия;
- рис, кукуруза.
Также к закислению приводят плохие привычки, недостаток или избыток физических нагрузок.
К здоровым продуктам, то есть щелочным, относят почти все овощи, бобовые, зелень, фрукты, ряд орехов. К методам ощелачивания относятся употребление натощак воды с лимонным соком, воды с перекисью водорода и т.д. Предполагается, что, употребляя такие продукты, мы ощелачиваем организм и повышаем его сопротивляемость почти всем на свете заболеваниям. И наоборот, употребляя кислую еду, мы способствуем развитию некоторых болезней.
Значение различных сред растворов и их определения[править]
Характер среды раствора имеет большое значение при протекании химических и биологических процессов. В зависимости от реакции среды эти процессы могут идти с разными скоростями и в разных направлениях
Поэтому определение pH среды растворов очень важно в медицине, науке, технике, сельском хозяйстве.
Постоянство концентраций ионов водорода — важный показатель внутренней среды живых организмов.
Изменение pH крови или желудочного сока является диагностическим тестом в медицине. Отклонения pH от нормальных величин даже на 0,01 единицы свидетельствуют о патологических процессах в организме.
При нормальной кислотности желудочный сок имеет pH 1,7 ;
Водородный показатель крови человека равен 7,4 ; слюны — 6,9 ; мочи — 6,0 .
Каждый фермент функционирует при определённом значении pH (каталаза крови при pH 7,0 ;
пепсин желудочного сока — при pH 1,5–2 ).
Различные продукты питания и широко используемые на практике вещества характеризуются определёнными значениями pH.
Водородные показатели продуктов питания и окружающих нас химических веществ очень различны.
Пример:
pH лимонного сока — 2,1 ;
pH апельсинового сока — 2,8 ;
pH чёрного кофе — 5,0 ;
pH молока — 6,9 ;
pH дождевой воды — 6,1 ;
pH раствора пищевой соды — 8,5 ;
pH нашатырного спирта — 11,9 .
Гидролиз солей
Растворимые в воде соли практически полностью диссоциируют на ионы. В некоторых солях катионы более реакционноспособны по сравнению с анионами, и они реагируют с водой с образованием ионов H+. Таким образом, раствор приобретает кислую среду:
M++H2O→MOH+H+M^+ + H_2O → MOH + H^+M++H2O→MOH+H+
В других солях анионы могут быть более реакционноспособными по сравнению с катионами, и они реагируют с водой с образованием ионов ОН-. Таким образом, раствор становится щелочным:
A−+H2O→HA+OH−A^-+ H_2O → HA + OH^-A−+H2O→HA+OH−
Процесс гидролиза соли фактически является обратной нейтрализацией:
Поскольку природа катиона или аниона соли определяет, будет ли ее раствор кислым или щелочным, целесообразно рассмотреть все четыре возможные комбинации.
Соли сильных кислот и слабых оснований
Раствор такой соли является кислым. Катион соли, пришедший из слабого основания, является реакционноспособным. Он реагирует с водой с образованием слабого основания и ионов H+.
B++H2O→BOH+H+B^+ + H_2O → BOH + H^+B++H2O→BOH+H+
Пример 1
Рассмотрим, например, NH4ClNH_4ClNH4Cl. Он полностью ионизован в воде на ионы NH4+NH_4^+NH4+ и Cl−Cl^-Cl−. Ионы реагируют с водой с образованием слабого основания (NH4OH)(NH_4OH)(NH4OH) и ионов H+H^+H+.
NH4++H2O→NH4OH+H+NH^+_4 + H_2O → NH_4OH + H^+NH4++H2O→NH4OH+H+
Таким образом, концентрация ионов водорода возрастает, и раствор становится кислым.
Соли слабых кислот и сильных оснований
Раствор такой соли является щелочным. Анион соли реагирует с водой с образованием слабых ионов кислоты и OH-ионов.
A−+H2O→HA+OH−A^- + H_2O → HA + OH^-A−+H2O→HA+OH−
Пример 2
Рассмотрим, например, соль CH3COONaCH_3COONaCH3COONa. Он полностью ионизирует в воде, чтобы дать ионы CH3COO−CH_3COO^-CH3COO− и Na+Na^+Na+. CH3COO−CH_3COO^-CH3COO− ионы реагируют с водой с образованием слабых кислот, ионов CH3COOHCH_3COOHCH3COOH и OH−OH^-OH− ионов.
CH3COO−+H2O→CH3COOH+OH−CH_3COO^- + H_2O → CH_3COOH + OH^-CH3COO−+H2O→CH3COOH+OH−
Таким образом, концентрация ионов OH-ионов возрастает, раствор становится щелочным.
Соли слабых кислот и слабых оснований
В случае соли такого типа гидролиз происходит максимально, так как катион и анион являются реакционноспособными и реагируют с водой с образованием ионов H+ и OH-. Образованный раствор, как правило, остается нейтральным, но он может быть либо слабо кислым, либо слабощелочным, если обе реакции происходят с разными скоростями.
Пример 3
Рассмотрим, например, соль CH3COONH4CH_3COONH_4CH3COONH4. Она диссоциирует на ионы ионы CH3COO−CH_3COO^-CH3COO− и ионы NH4+NH_4^+NH4+, которые реагируют с водой:
CH3COO−+H2O→CH3COOH+OH−CH_3COO^- + H_2O → CH_3COOH + OH^-CH3COO−+H2O→CH3COOH+OH−
NH4++H2O→NH4OH+H+NH^+_4 + H_2O → NH_4OH + H^+NH4++H2O→NH4OH+H+
Когда pKa = pKb, pH = 7, то есть раствор соли будет нейтральным.
Когда pKa > pKb. Раствор будет щелочным, так как кислота будет немного слабее, чем основание, а значение pH будет больше 7.
В случае pKa < pKb раствор будет кислым, так как кислота относительно сильнее основания, а pH будет меньше 7.
Соли сильных кислоты и сильных оснований
Такая соль, например NaClNaClNaCl, не подвергается гидролизу, так как ионы не реагируют. Таким образом, раствор будет нейтральным.
Кислотно-щелочной баланс человека
Организмом человека вырабатываются разные жидкости, каждая из которых должна иметь определенное значение pH. Отклонение в ту или иную сторону может привести к развитию множества серьезных заболеваний. Вовремя обнаруженные изменения можно исправить, если повысить или понизить кислотность потребляемых продуктов и питьевой воды. Механизм регулирования пропорционального соотношения кислот и щелочей в клеточных и межклеточных жидкостях называют кислотно-щелочным балансом (равновесием). По значению pH можно определить, в каком состоянии находятся многие органы человека.
На pH почек и печени оказывают влияние не только метаболические процессы в самом организме, но также пища и вода. Излишнюю кислотность потребленных продуктов организм выводит через мочу. Низкий уровень pH мочи говорит о том, что почки работают на пределе. Когда излишняя кислота не может быть выведена из организма естественным путем, она скапливается в подкожной жировой прослойке, имеющей кислотный pH. Это приводит к излишнему весу. В борьбе с этим явлением помогает щелочная вода, снижая нагрузку на почки.
В желудке среда резко кислая, в момент пищеварения pH равен 1,8−3. Вопреки распространненому мнению, причиной таких неприятных симптомов, как изжога и дискомфорт в желудке, является пониженная, а не повышенная кислотность желудочного сока. Нормальный уровень pH создает благоприятные условия для развития правильных бактерий и запускает механизм переваривания пищи, а болезнетворные микроорганизмы и гельминты расщепляются пищеварительными ферментами.
pH крови организм поддерживает в постоянном состоянии на уровне 7,4—7,45. Малейшее отклонение его от нормы может привести к тяжелым последствиям для человека. При понижении pH ниже 7,35 возникает ацидоз. При превышении нормы — алкалоз. Это не самостоятельные заболевания, они свидетельствуют о нарушениях в работе легких, почек, печении. Такие состояния сопровождаются очень опасными для здоровья симптомами, приводящими иногда даже к коме. По мнению врачей, ацидоз переносится легче алкалоза.
Кровеносные сосуды питают слюнные железы, поэтому за уровнем pH крови можно следить по pH слюны. Поддержание кислотно-щелочного баланса в кровеносной системе — это важнейшая функция организма человека. Внешние факторы не оказывают влияния на pH крови, он регулируется только внутренними механизмами тела человека:
- Буферные системы крови поддерживают устойчивость среды.
- Легочная (респираторная) система удаляет излишки углекислого газа из крови.
- Выделительная система (почки). Самый медленный, но и самый мощный механизм, может полностью восстанавливать pH организма путем выведения ионов водорода через мочу.
Таким образом, хотя кислотный показатель крови совершенно не подвержен внешнему влиянию, механизмы его поддержания на нужном уровне имеют зависимость от того, чем человек питается и какую воду пьет. Мясо и молоко повышают общую кислотность организма, а зелень и зеленые овощи лучше всего нейтрализуют ее. Кислотность и щелочность различных пищевых продуктов можно узнать из специальных таблиц. Оптимальное значение pH для воды находится в пределах от 6 до 9.
Придерживаясь принципов правильного питания для поддержания кислотно-щелочного равновесия в своем организме, человек надолго сохранит молодость, красоту и здоровье.
Общая информация
В 80% случаев, причиной развития воспалительного процесса с повышенной кислотностью желудка, является микроорганизм Хеликобактер Пилори, которая нарушает естественные защитные свойства желудка и приводит к повреждению эпителия органа. Гастрит с повышенной кислотностью может развиваться у людей независимо от возраста, в том числе у детей.
К другим факторам, предрасполагающим к развитию данного состояния, можно отнести:
- Регулярное воздействие стресса на организм.
- Нерациональное питание, преобладание в рационе жареной и жирной пищи, а также блюд, приготовленных во фритюре.
- Злоупотребление так называемыми перекусами.
- Длительное или бесконтрольное использование препаратов из группы нестероидных противовоспалительных средств. Частое употребление слишком горячей или слишком холодной пищи. Кроме того, высокая предрасположенность к развитию гиперацидного гастрита имеется у людей с заболеваниями щитовидной железы, сахарным диабетом и подагрой.
Чем опасна повышенная кислотность
Желудочный сок содержит соляную кислоту, которая необходима для расщепления компонентов пищи. Для того чтобы кислотная среда не повреждала стенки желудка, вырабатывается защитная слизь. При повышенной кислотности желудка наблюдается разрушение слизистого защитного слоя, с последующим формированием воспалительного процесса, образованием эрозий и язв.
Клинические симптомы
Воспалительное поражение органа с увеличением секреции желудочного сока чаще обостряется в период межсезонья, в осенние или весенние месяцы. К симптомам повышенной кислотности желудка можно отнести:
- Тянущая или схваткообразная боль в подложечной области, которая чаще усиливается после приема пищи. При остром течении воспалительного процесса, боль может сопровождаться рвотой, которая приносит временное облегчение.
- Изжога, которая вызвана забросом кислотного содержимого желудка в пищевод.
- Отрыжка кислым.
- Неприятный запах изо рта.
- Расстройства стула в виде запоров или диареи.
К другим симптомам повышенной кислотности желудка при гастрите относится слабость, головокружение, повышенная потливость, избыточное газообразование в кишечнике (метеоризм), усиленное слюноотделение, повышение или снижение аппетита, появление белого или серого налёта на поверхности языка. Пониженная кислотность желудка сопровождается такими симптомами, как уменьшение аппетита, ощущение тяжести в эпигастрии, отрыжка тухлым.
Измерение водородного показателя
Формулы для расчета pH зависят от того, к какому классу относится химическое вещество, входящее в исследуемый раствор, и приведены в специальных справочниках. Более точное значение получают другими методами. Цели и условия проведения исследований определяют, как будет измеряться водородный показатель.
Индикаторные способы
Приблизительно оценить меру активности ионов водорода можно с помощью кислотно-основных индикаторов. Такие вещества обычно относятся к органическим соединениям и имеют свойство изменять свой цвет в разных средах:
- Лакмус меняет цвет от красного в кислой среде через фиолетовый в нейтральной до синего в щелочной.
- Фенолфталеин становится синим в щелочной среде, оставаясь бесцветным в остальных.
- Метилоранж розового цвета соответствует повышенной кислотности, оранжевого — показывает нейтральность среды, в щелочах становится синим.
Изменение происходит для каждого индикатора в своём диапазоне кислотности, обычно составляющем 1—2 единицы. При этом методе результат можно получить быстрый и наглядный при небольших затратах, но недостаточно точный, с большой погрешностью при исследовании очень слабых растворов, окрашенных или мутных вод. Используется, когда нужно найти предварительное определение pH.
Более широкий диапазон и выше точность у универсального индикатора. Он соединяет в себе несколько индикаторов и градуируется в соответствии со значениями pH от единицы до десяти. Соответствие значения водородного показателя и цвета:
- 1 — красный;
- 2 — розовато-оранжевый;
- 3 — оранжевый;
- 4 — темно-желтый;
- 5 — желтый;
- 6 — желтовато-зеленый;
- 7 — светло-зеленый;
- 8 — насыщенный зеленый;
- 9 — сине-зеленый;
- 10 — сине-серый.
Аналитический объемный метод
Кислотно-основное титрирование — метод определения водородного показателя среды с помощью так называемых титрантов. В основном для этого используются сильные кислоты (серная, соляная) и сильные щелочи (едкий калий, каустическая сода).
Раствор-титрант добавляют в исследуемую жидкость по каплям. При этом они вступают в химическую реакцию. Когда она завершается, наступает точка эквивалентности, т. е. момент отчетливого изменения окраски исследуемого раствора. По установленному в результате опыта объему титранта, необходимому для получения точки эквивалентности, и известному значению его концентрации можно рассчитать pH с высокой точностью.
Измерительный прибор pH-метр
Ионометрический метод, при котором кислотный показатель можно измерить с помощью специализированного прибора — pH-метра, является наиболее точным (до сотых от единицы pH), удобным и имеет широкий диапазон измерения. PH-метр представляет собой милливольтметр, способный измерять разность потенциалов со стеклянных электродов. У него также есть система пересчета напряжения в pH.
В исследуемый раствор погружают индикаторный электрод и электрод сравнения, замыкая таким образом гальваническую цепь. Величина электродвижущей силы в ней зависит от активности ионов H+ в растворе, т. е. является функцией только его pH. Индикаторный электрод состоит из стеклянной трубки, заполненной специальной суспензией в растворе соляной кислоты, и погруженной в нее серебряной проволоки.
Специализированный прибор, применяемый в медицине для исследований pH жидкостей желудочно-кишечного тракта, называется ацидогастрометром. Включает в себя регистрирующий блок и один или несколько зондов. Для измерения уровня pH таких биологических жидкостей, как слюна и моча, применяются электронные pH-метры.
Популярные вопросы
Мне нужно средство с нейтральным ph, а ещё очень важный момент, на очень многие средства интимной гигиены известных марок у меня возникает аллергия. Являются ли ваши средства гипоаллергенными и какое вы можете мне посоветовать?
В Вашем случае подойдет гель Гинокомфорт с экстрактом мальвы, если нет аллергии на его составляющие, указанные в инструкции.
Здравствуйте, какой pH у кремов?
У гелей Гинокомфорт, содержащих молочную кислоту (моющий гель для интимной гигиены и восстанавливающий гель с маслом чайного дерева линии Гинокомфорт), рН 4,2, что соответствует слабо-кислой среде половых путей. Гель увлажняющий Гинокомфорт имеет нейтральную рН среду.
Что такое pН воды
Показатель pH является единицей активности иона водорода, которая равна обратному логарифму активности водородных ионов. Так, например, вода, pH которой составляет 7, обладает 10–7 моль на один литр ионов водорода. Следовательно, жидкость с pH равном 6 – 10–6 моль на один литр. Шкала показателей pH при этом варьирует в диапазоне от 0 до 14. Если pH воды менее 7, то она является кислой, а если более 7 – тогда щелочной. Норма pH для поверхностных водных систем составляет 6,5–8,5, для подземных – 6–8,5.
Показатель pH воды равняется 7 при 25 °С, но при взаимодействии с диоксидом углерода в атмосфере данное значение будет составлять 5,2. Уровень pH тесно связан с атмосферным газом и температурой, поэтому воду следует проверить в самые короткие сроки. pH воды не сможет дать полной характеристики и повода для ограничения подачи воды.
Когда в воде растворяются различные химические вещества, то данный баланс подлежит изменению, что, в свою очередь, провоцирует изменение показателя pH. Если в воду добавить кислоту, концентрация ионов водорода возрастает, и концентрация гидроксид-ионов, в свою очередь, понижается. Если в жидкость добавить щелочь, тогда концентрация гидроксид-ионов возрастает, а содержание ионов водорода понижается.
Статьи, рекомендуемые к прочтению:
Уровень pН воды показывает уровень кислотности или щелочности среды, а кислотность и щелочность характеризуется количественным содержанием в воде элементов, нейтрализующих щелочь и кислоту. Так, например, температура отражает уровень нагрева вещества, но не количественный показатель тепла. Если мы коснемся воды рукой, то мы определим, теплая она или холодная, но мы не сможем сказать, какое количество тепла в ней содержится (другими словами, сколько потребуется времени для того, чтобы вода остыла).
Показатель pH – один из основных качественных характеристик воды. Он отражает кислотно-щелочной баланс и определяет, каким образом будут происходить те или иные биологические и химические процессы. Величиной pH воды определяется скорость протекания той или иной химической реакции, уровень коррозионной агрессивности жидкости, степень токсичности загрязняющего вещества и многие другие факторы. Более того, кислотно-щелочной баланс среды организма определяет наше состояние здоровья, настроение и самочувствие.
Различают следующие группы воды, в зависимости от показателя pH:
|
Тип воды |
Величина рН |
|
Сильнокислые воды |
<3 |
|
Кислые воды |
3–5 |
|
Слабокислые воды |
5–6,5 |
|
Нейтральные воды |
6,5–7,5 |
|
Слабощелочные воды |
7,5–8,5 |
|
Щелочные воды |
8,5–9,5 |
|
Сильнощелочные воды |
>9,5 |
Контролировать уровень pН воды необходимо на каждом этапе очистки жидкости, поскольку смещение баланса может негативно отразиться на вкусовых качествах, запахе и оттенке воды, а также снизить эффективность ее очистки.
Читайте материал по теме: Безопасность питьевой воды
Оценка состояния культурных растений
Помимо оценки видового состава присутствующих на участке сорных трав, стоит обратить внимание и на внешний вид огородных культур. Так, ботва свеклы, возделываемой в кислом субстрате, становится красной
При выращивании ее в условиях слабокислых почв краснеют только прожилки на листьях.
Виды, не приспособленные к культивированию на кислых почвах, часто болеют. Капуста и редис поражаются килой, плодовые деревья сбрасывают завязи, а лук погибает из-за шейковой гнили. В периоды засухи такие земли слеживаются плотными крупными кусками, внутри которых формируются белесые прослойки, внешне напоминающие золу.
Тестирование уровня pH кислотно-щелочного баланса
Вот так можно проверить свой собственный уровень рН
- Вы можете проверить свой pH, купив специальные индикаторные полоски в местном магазине здоровой пищи или аптеке.
- Измерение pH можно проводить по слюне или моче. Второе утреннее мочеиспускание даёт лучшие по точности результаты pH.
- Вы сравниваете цвета на тест-полоске с диаграммой масштаба pH, которая поставляется вместе с этим комплектом тест-полосок.
- В течение дня лучшее время для проверки pH — один час до еды и два часа после еды.
- Если вы тестируете свою слюну, то идеальный для здоровья диапазон pH между 6,8 и 7,3 (помните, что оптимальный pH составляет около 7,365).
Понятие о рН (водородном показателе)
Вода — очень слабый электролит: при обычных условиях лишь одна молекула воды из 10 000 000 распадается на ионы:
Это уравнение показывает, что при диссоциации 1 моль молекул воды образуется 1 моль ионов водорода Н+ и 1 моль гидроксид-анионов ОН–. Другими словами: в чистой воде концентрация ионов водорода равна концентрации гидроксид-анионов:
Здесь: — равновесная концентрация ионов водорода, моль/л; — равновесная концентрация гидроксид-анионов, моль/л.
Такой раствор (среда) называется «нейтральный».
Характер среды — кислый, нейтральный — можно оценить количественно при помощи рН («пэ-аш»). Водородный показатель рН равен логарифму концентрации ионов водорода, взятому с обратным знаком*:
Поэтому в случае чистой воды рН = 7.
Раствор, у которого рН = 7, называется нейтральным.
Если к чистой воде добавили кислоту, то увеличили концентрацию ионов водорода. Теперь эта концентрация составит, например 10–6 моль/л или 10–2 моль/л.
Такая среда (раствор) называется «кислая», или «кислотная». Причём в первом случае (рН = 6) среда считается слабокислой, а во втором (рН = 2) — сильнокислой, т. е. в любом случае рН < 7. Значение рН можно измерять и с большей точностью (например, рН = 5,36).
pН < 7, среда кислая.
При добавлении щёлочи увеличивается концентрация ионов ОН–, и одновременно уменьшается концентрация ионов Н+. Дело в том, что для любого водного раствора
Поэтому, если концентрация ионов ОН– составит 10–3, то = 10–11, т. е.
рН > 7, среда щелочная.
Определить реакцию среды конкретного раствора можно при помощи индикаторов.
Индикаторы — это вещества, которые изменяют свой цвет в присутствии избытка ионов Н+ или ОН–.
Ионы Н+ или ОН– действуют на молекулу индикатора, и индикатор меняет цвет по-разному в зависимости от реакции среды и вида самого индикатора (табл. 7).
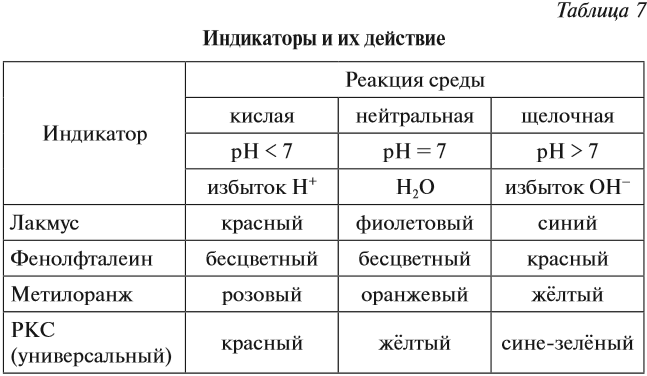
Задание 6.10. Какую окраску будет иметь индикатор лакмус, если:
- рН < 7;
- = 10–4 моль/л;
- в растворе есть избыток ОН–;
- рН = 7;
- = 10–8 моль/л;
- в растворе есть НNО3;
- = 0,1 моль/л.
Окраска индикаторов изменяется в растворах, которые содержат избыток одного из этих ионов. Ионы Н+ или ОН– могут образовываться в ходе диссоциации некоторых соединений.
Вопрос. Какие вещества при диссоциации образуют ионы Н+ или ОН–?
Эти ионы могут образовываться при диссоциации растворимых кислот, оснований, некоторых кислых и основных солей. Например, дигидрофосфат натрия образует при диссоциации ионы водорода, а гидрофосфат натрия — нет. Дело в том, что кислые соли могут диссоциировать ступенчато, если полученный на первой стадии анион соответствует сильному электролиту:
остаток слабого электролита → диссоциация не идёт;
остаток сильного электролита → диссоциация идёт:
Образуются ионы Н+, возникает кислая среда.
Кроме того, ионы Н+ или ОН– могут образовываться в ходе взаимодействия некоторых веществ с водой. Например, с водой могут взаимодействовать активные металлы, кислотные и основные оксиды.
Задание 6.11. Какую окраску будет иметь индикатор лакмус, если в воде растворить: кальций, оксид лития, оксид серы (IV)?







