Добыча, представление и цена
Большая часть молибдена получается как побочный продукт при производстве меди и только около 30% — непосредственно из молибденовых руд. Все руды в основном перерабатываются в гептамолибдат аммония . Это достигается прокаливанием при температуре около 400 ° C в перенесенном триоксиде молибдена MoO 3 . Последний восстанавливается до чистого порошка молибдена в две стадии с использованием водорода . На первом этапе образуется метастабильный коричнево-фиолетовый диоксид молибдена MoO 2 при температуре 500–600 ° C , на втором этапе — чистый металлический порошок при температуре около 1100 ° C. Молибден прессуется в компактный металл в процессе HIP путем переплавки в дуговой печи в атмосфере аргона в качестве защитного газа или в электронно-лучевой печи . Монокристаллы производятся методом зонной плавки . Молибден восстановление из лома составляет почти 100% , поскольку нет никаких потерь окисления.
- (NЧАС4-й)6-еМ.О7-еО24⟶7-е М.ОО3+6-е NЧАС3+3 ЧАС2О{\ displaystyle \ mathrm {(NH_ {4}) _ {6} Mon_ {7} O_ {24} \ longrightarrow 7 \ MoO_ {3} +6 \ NH_ {3} +3 \ H_ {2} O}}
- М.ОО3+ЧАС2⟶М.ОО2+ЧАС2О{\ displaystyle \ mathrm {MoO_ {3} + H_ {2} \ longrightarrow MoO_ {2} + H_ {2} O}}
- М.ОО2+2 ЧАС2⟶М.О+2 ЧАС2О{\ displaystyle \ mathrm {MoO_ {2} +2 \ H_ {2} \ longrightarrow Mo + 2 \ H_ {2} O}}
Мировое производство в 2007 году составило 211 000 тонн (179 000 тонн в 2006 году). В 2007 году США, как крупнейший производитель, произвели 62 000 тонн, Китай — 60 000 тонн и Чили — 45 000 тонн. В 2013 году общий объем производства молибдена составил 258 000 тонн; Основными производителями были Китай (101 000 т), США (60 700 т), Чили (38 700 т) и Перу (18 100 т). По данным USGS, цены на молибден составляют 34,83 доллара США за кг в 2010 году и 22,85 доллара США за кг в 2013 году. На Лондонской бирже металлов в 2018 году цена на молибден составляла около 25 долларов за кг.
Современная классификация нержавеющей стали
Нержавеющая сталь – это разновидность легированной стали, устойчивая к коррозии за счет содержания хрома. В присутствии кислорода образуется оксид хрома, который создает на поверхности стали инертную пленку, защищающую все изделие от неблагоприятных воздействий.

Не каждая марка нержавеющей стали демонстрирует устойчивость хромоксидной пленки к механическим и химическим повреждениям. Хотя пленка восстанавливается под воздействием кислорода, были разработаны специальные марки нержавейки для применения в агрессивных средах.
Первый условный тип разбиения на группы:
- Пищевая
- Жаропрочная сталь
- Кислотостойкая сталь
Второй тип классификации — по микроструктуре:
- Аустенитные (Austenitic) — не магнитная сталь с основными составляющими 15-20% хрома и 5-15% никеля который увеличивает сопротивление коррозии. Она хорошо подвергается тепловой обработке и сварке. Именно аустенитная группа сталей наиболее широко используется в промышленности и в производстве элементов крепежа.
- Мартенситные (Martensitic) — значительно более твердые чем аустетнитные стали и могут быть магнитными. Они упрочняются, закалкой и отпуском подобно простым углеродистым сталям, и находят применение главным образом в изготовлении столовых приборов, режущих инструментов и общем машиностроении. Больше поддвержены коррозии.
- Ферритные (Ferritic) стали значительно более мягкие чем мартенситные по причине малого содержания углерода. Они также обладают магнитными свойствами.
Роль в растении
Биохимические функции
Молибден входит в состав немногих растительных белков. Он поступает в растения в форме аниона Mo2-4 и концентрируется в растущих, молодых организмах. Наибольшее его количество содержат бобовые, причем, в листьях его больше, чем в корнях и стеблях. В листовых пластинках молибден сосредоточен в составе хлоропластов.
Установлено, что корневые клубеньки содержат в несколько раз больше молибдена, чем ткани листьев. Значительная часть элемента в клубеньках связана с нитратредуктазой корней и стеблей и, кроме того, нитрогеназой клубеньковых бактерий. Молибден – важный компонент нитрогеназы и нитратредуктазы. Эти два молибденсодержащих фермента непосредственно участвуют в метаболизме азота, играя важную роль как в фиксации N2, так и в восстановлении оксида азота NO3. Потребность растений в молибдене непосредственно связана с обеспечением их азотом. Однако установлено, что растения, поглощающие NH4–N, испытывают гораздо меньшую потребность в молибдене, чем усваивающие NO3–N.
Молибден присутствует и в других ферментах (оксидазах), ускоряющих разнообразные, не связанные между собой реакции. Основная ферментативная роль молибдена непосредственно связана с функцией переноса электронов. Этому способствует переменная валентность Mo.
Молибден, как и железо, необходим для синтеза леггемоглобина (белка – переносчика кислорода в клубеньках). Его дефицит приводит к изменению цвета клубеньков на желтый или серый (нормальная окраска красная). Известно более 20 молибденосодержащих ферментов. Среди них альдегидоксидаза (катализирует превращение абсцизового альдегида в фитогормон абсцизовую кислоту), сульфитоксилаза (окисляет SO2-3 до SO2-4), ксантиндегидрогеназа и другие. Во всех вышеперечисленных ферментах молибден присутствует в виде молибдоптерина, именуемого молибденовым фактором, что обеспечивает устойчивость молибдена к окислению.
Недостаток (дефицит) молибдена в растениях
Симптомы дефицита молибдена проявляются у растений, находящихся на кислых минеральных почвах с высоким содержанием гидроксидов марганца и железа. Обострение дефицита вызывает присутствие в почвенном растворе сульфатных анионов, конкурирующих с анионами молибдата. Критический уровень содержания молибдена в растениях колеблется от 0,1 до 1 мг/кг сухой массы листьев.
Изменение внутреннего строения
При дефиците молибдена растения становятся неустойчивы к низким температурам и дефициту воды. Наблюдаются нарушения в формировании пыльцы.
Внешние признаки
Например, у капусты пятнистость сопровождается увяданием краев листьев, а у томата и картофеля листовые пластинки закручиваются.
Недостаток молибдена негативно сказывается и на формировании цветков. У томатов они мельчают, почти сидят на стебле и не раскрываются, у цветной капусты деформируются и становятся рыхлыми. У бобовых при недостатке данного элемента нарушается образование клубеньков на корнях.
Избыток молибдена
Фитотоксичность молибдена проявляется только в очень высоких его концентрациях. Например, признаки молибденового отравления молодых проростков ячменя отмечались при содержании Mo 135 мг/кг сухой массы.
Избыток молибдена в растениях токсичен для животных и человека. Применять молибденовые микроудобрения следует с учетом токсичности этого элемента для животных и человека, проявляющейся даже при крайне низких концентрациях. Особенно это характерно для кормовых растений.
Молибден – малораспространенный элемент. Молибденовые удобрения получают из молибденовых руд. Массовая доля металла в них составляет 0,1–1 %. В дополнение к этому источнику, значительную часть молибдена добывают из различных отходов промышленности, в частности, электролампового производства.
Химические свойства
Молибден, химические свойства которого приведены ниже, имеет следующие характеристики:
- радиус валентности — 130·10-12 м;
- ионный радиус — (+6e) 62 (+4e) 70·10-12 м;
- электрическая отрицательность — 2,15;
- потенциал электрический – 0;
- валентности при окислении — 2-3-4-5-6
- валентность молибдена – 6;
- температура начала окисления — 400°С;
- окисление до МоО3 при температуре — 600°С и выше;
- реакция с водородом – нейтральная;
- температура реакции с хлором – 250°С;
- температура реакции с фтором – комнатная;
- температура реакции с серой – 440°С;
- температура реакции с азотом — 1500°С.
С кислородом элемент образует два основных оксида:
- МоО3 – кристаллическая форма белого цвета
- МоО2 – серебристого цвета.

Молибден MoS2
Свойства растворимости молибдена в химических растворах: растворим в щелочах и кислотах при нагревании. Это способствует получению различных соединений или его очищению.
Процессы получения молибдена
Флотация
Флотация (фактически – плавание на поверхности жидкости частиц, предварительно обработанных маслами и воздухом) является основным методом обогащения молибденовых руд.
Молибденит – основной минерал для получения молибдена, ведь именно он обеспечивает 99% потребности индустрии в этом металле, хорошо подвергается флотации. Дело в том, что в процессе измельчения молибденита раскрываются поверхности, обладающие сильными гидрофобными (не смачиваемыми водой) свойствами.
Используя для пенообразования сосновое масло, а в качестве коллекторов – масла тяжёлых нефтяных фракций, добиваются получения 90% концентрата. Процесс происходит поэтапно:
- В начале – флотируются сульфиды.
- Затем – молибденит с подавлением железа и сульфидов меди под воздействием соединений натрия в щелочной среде.
Неоднократность повторений даёт возможность достигнуть высокого уровня концентрации молибдена.
Обжиг
В основе получения трёхокиси молибдена, применяемой для легирования сталей, выплавки ферромолибдена, получения молибденовых солей высокой степени чистоты, и являющейся сырьём на пути: трёхокись или ангидрид – порошок – компактный ковкий металл, лежит процесс окислительного обжига.
Концентраторы загружают в печь и подвергают нагреву при температуре 600-6500C, не допуская при этом перегрева и плавления. Результатом процесса выступают полезные молибдаты, а также окислы и сульфаты посторонних примесей. Для обжига используются многоподовые печи с перемешиванием, муфельные, камерные печи с ручным перегребанием огарка, вращающиеся трубчатые агрегаты или печи с кипящим слоем.

Обработка давлением
Полученные слитки молибдена в целях изготовления нужных форм, проходят горячую обработку давлением. Для этого, чтобы изменить внутреннюю структуру отливки, рекомендуется предварительно подвергнуть её прессованию. В этом направлении существует немало перспективных разработок. В частности, одна из них предусматривает обдув воздухом и звуковое воздействие частотами 140-160дБ, на протяжении 10-20 минут. Это значительно сокращает процесс обработки и обеспечивает необходимый уровень механических характеристик.
History
Until the late eighteenth century, the compounds of molybdenum were confused with those of other elements, such as carbon or lead. In 1778, Carl Wilhelm Scheele was able to determine that molybdenum was separate from graphite and lead, and he isolated the oxide of the metal from molybdenite. In 1782, Hjelm isolated an impure extract of the metal by reducing the oxide with carbon. Molybdenum was little used and remained in the laboratory until the late nineteenth century. Subsequently, a French company (Schneider and Co.) tried molybdenum as an alloying agent in steel armor plating and noted its usefulness as a hardener of steel. Molybdenum use soared during World War I, when the increased demand for tungsten made that element scarce and high-strength steels were at a premium.
Суточная норма молибдена
Рекомендованная суточная норма потребления молибдена для различных категорий:
Дети:
- 1–3 года: 17 мкг в сутки
- 4–8 лет: 22 мкг в сутки
- 9–13 лет: 34 мкг в сутки
- 14–18 лет: 43 мкг в сутки
Взрослые:
| Все взрослые старше 19 лет: | 45 мкг в сутки |
| Беременные или кормящие женщины | 50 мкг в сутки |
Допустимый максимальный уровень потребления этого микроэлемента по возрастным группам приведен ниже:
- Младенцы в возрасте от 0 до 12 месяцев: установить невозможно, но источник потребления должен быть только из пищи и смеси.
- Дети 1-3 лет: 300 мкг в день
- Дети 4–8 лет: 600 мкг в день
- Дети 9–13 лет: 1100 мкг в день (1,1 мг в день)
- Подростки 14–18 лет: 1700 мкг в день (1,7 мг в день)
- Взрослые 19 лет и старше: 2000 мкг в день (2,0 мг в день)
Для большинства людей дополнительный прием молибдена не требуется, так как при сбалансированном питании, его недостаток встречается крайне редко.

История открытия
Молибден впервые был получен в XVIII в. А до этого времени его соединения из-за внешнего свойства по ошибке отождествляли с другими веществами. Одно из таких соединений, молибденовый блеск или молибденит, MoS2, своей мягкостью и блестящей поверхностью было очень похоже на графит и на свинцовый блеск, PbS.
Данные вещества объединяли общим названием молибден от греч. молюбдос, свинец. В 1778 г. шведский химик Шееле подверг молибденит взаимодействию с азотной кислотой. В результате была получена молибденовая кислота. Затем из молибденовой кислоты был получен оксид молибдена, а из оксида – чистый металлический молибден.
Свойства молибдена (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Молибден |
| 102 | Прежнее название | |
| 103 | Латинское название | Molybdaenum |
| 104 | Английское название | Molybdenum |
| 105 | Символ | Mo |
| 106 | Атомный номер (номер в таблице) | 42 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1778 г. |
| 110 | Год открытия | 1778 г. |
| 111 | Внешний вид и пр. | Блестящий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 9,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,00012 % |
| 124 | Содержание в организме человека (по массе) | 0,00001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 95,96(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s1 |
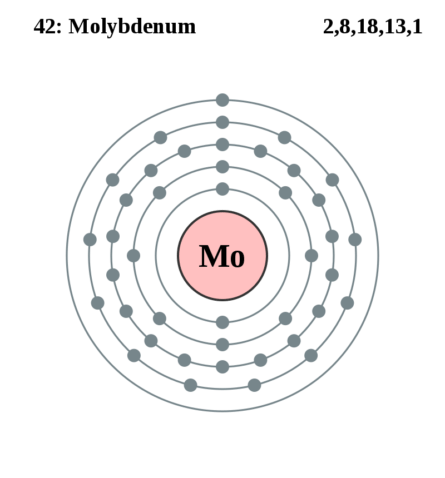
| 203 | Электронная оболочка |
K2 L8 M18 N13 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 190 пм |
| 205 | Эмпирический радиус атома* | 154 пм |
| 206 | Ковалентный радиус* | 154 пм |
| 207 | Радиус иона (кристаллический) | Mo3+
83 (6) пм, Mo4+ Mo5+ 75 (6) пм, Mo6+ 73 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 42 электрона, 42 протона, 54 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1,+2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,16 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 684,32 кДж/моль (7,09243(4) эВ) |
| 305 | Электродный потенциал | Mo3+ + 3e– → Mo, Eo = -0,2 В |
| 306 | Энергия сродства атома к электрону | 71,9 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 10,28 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело),
9,33 г/см3 (при температуре плавления 2623 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 2623 °C (2896 K, 4753 °F) |
| 403 | Температура кипения* | 4639 °C (4912 K, 8382 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 37,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 598 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,251 Дж/г·K (при 25 °C), 0,272 Дж/г·K (при 0-100 °C) |
| 410 | Молярная теплоёмкость* | 24,06 Дж/(K·моль) |
| 411 | Молярный объём | 9,4 см³/моль |
| 412 | Теплопроводность | 138 Вт/(м·К) (при стандартных условиях),
138 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
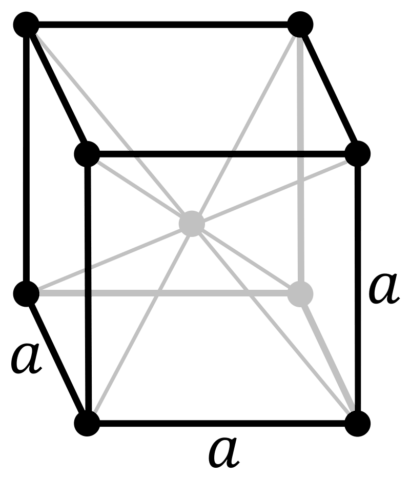
| 512 | Структура решётки |
Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,147 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 450 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-98-7 |
Примечание:
205* Эмпирический радиус атома молибдена согласно и составляет 139 пм.
206* Ковалентный радиус молибдена согласно и составляет 154±5 пм и 130 пм соответственно.
401* Плотность молибдена согласно и составляет 10,22 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления молибдена согласно составляет 2620 °С (2893,15 K, 4748 °F).
403* Температура кипения молибдена согласно и составляет 4611,85 °С (4885 K, 8333,33 °F) и 4630 °С (4903,15 K, 8366 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) молибдена согласно и составляет 28 кДж/моль и 36,4 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) молибдена согласно составляет 582,4 кДж/моль.
410* Молярная теплоёмкость молибдена согласно составляет 23,93 Дж/(K·моль).
Функции в теле
Молибден является важным микроэлементом для жизни, поскольку он присутствует в качестве кофактора в многочисленных ферментах. Оксотрансферазы используют молибден в качестве кофактора для выполнения своей функции переноса кислорода из воды с помощью пары электронов..
Среди оксотрансфераз есть:
- Ксантиноксидаза.
- Альдегидоксидаза, которая окисляет альдегиды.
- Амины и сульфиды в печени.
- Сульфитоксидаза, которая окисляет сульфит в печени.
- Нитратредуктаза.
- Нитритредуктаза, присутствующая в растениях.
Фермент ксантин
Фермент ксантиноксидаза катализирует конечную стадию катаболизма пуринов у приматов: превращение ксантина в мочевую кислоту, соединение, которое затем выделяется.
Ксантиноксидаза имеет кофермент FAD. Кроме того, негеминовое железо и молибден вмешиваются в каталитическое действие. Действие фермента может быть описано с помощью следующего химического уравнения:
Ксантин + Н2O + O2 => Мочевая кислота + H2О2
Молибден вмешивается как кофактор молибдоптерин (Mo-co). Ксантиноксидаза обнаруживается в основном в печени и тонкой кишке, но использование иммунологических методов позволило ее найти в молочных железах, скелетных мышцах и почках.
Фермент ксантиноксидаза ингибируется препаратом алопуринол, применяемым при лечении подагры. В 2008 году началась коммерциализация препарата Febuxostat с лучшими показателями при лечении заболевания..
Фермент альдегид оксидаза
Фермент альдегидоксидаза находится в клеточной цитоплазме, обнаруженной как в царстве растений, так и в царстве животных. Фермент катализирует окисление альдегида в карбоновой кислоте.
Он также катализирует окисление цитохрома Р450 и промежуточные продукты фермента моноаминоксидазы (МАО).
Благодаря своей широкой специфичности, фермент альдегидоксидаза может окислять многие лекарства, выполняя свою функцию в основном в печени. Действие фермента на альдегид можно схематизировать следующим образом:
Альдегид + Н2O + O2 => Карбоновая кислота + H2О2
Фермент сульфитоксидаза
Фермент сульфитоксидаза участвует в превращении сульфита в сульфат. Это конечная стадия разложения серосодержащих соединений. Катализируемая ферментом реакция происходит по следующей схеме:
SW3-2 + H2О + 2 (цитохром С) окислен => SO4-2 + 2 (цитохром С) пониженный + 2 Н+
Дефицит фермента в результате генетической мутации у человека может привести к преждевременной смерти.
Сульфит является нейротоксичным соединением, поэтому низкая активность фермента сульфитоксидазы может вызвать психическое заболевание, умственную отсталость, умственную деградацию и, в конечном итоге, смерть.
В обмене железа и в качестве компонента зубов
Молибден вмешивается в метаболизм железа, способствуя его всасыванию в кишечнике и образованию эритроцитов. Кроме того, он входит в состав зубной эмали и вместе с фтором помогает в профилактике кариеса..
дефицит
Дефицит в потреблении молибдена был связан с повышенной заболеваемостью раком пищевода в регионах Китая и Ирана по сравнению с регионами Соединенных Штатов с высоким уровнем молибдена.
Биологическая роль молибдена
Функции молибдена:
• Участвует в обмене белка и пуриновых оснований. Регулирует превращения органических веществ, содержащих азот (это один из 4 основных элементов живых организмов) • Способствует выведению из организма продуктов обмена веществ, нейтрализации токсинов • Играет важную роль в образовании гемоглобина • Улучшает усвоение и эффекты витаминов Е, , , , РР • Принимает участие в жировом обмене • Способствует снижению глюкозы в крови • Оказывает положительное влияние на состояние печени • Способствует осуществлению тканевого дыхания • Улучшает функцию репродуктивной системы • Снижает токсическое влияние алкоголя на организм • Препятствует развитию аллергии • Улучшает состояние зубов.
Жаропрочные сплавы
Техника сверхскоростных и космических полетов ставит перед металлургами задачу получать все более жаростойкие материалы. Прочность при высоких температурах зависит прежде всего от типа кристаллической решетки и, конечно, от химической природы материала. Температурный предел эксплуатации титановых сплавов 550— 600° С, молибденовых — 860, а титано-молибденовых — 1500° С!
Чем объяснить столь значительный скачок? Его причина — в строении кристаллической решетки. В объемно-центрированную структуру молибдена внедряются посторонние атомы, на этот раз атомы титана. Получается так называемый твердый раствор внедрения, структуру которого можно представить так. Атомы молибдена, металла-основы, располагаются по углам куба, а атомы добавленного металла, титана,—в центрах этих кубов. Вместо объем-по-центрированной кристаллической решетки появляется гранецентрированная, в которой процессы разупрочнения под действием температур происходят намного менее ий-
В таком целенаправленном изменении кристаллической структуры металлов состоит один из основных принципов легирования.
Другая причина столь резкого увеличения жаропрочности кроется в том, что сплавляются очень непохожие металлы — молибден и титан. Это общее правило: чем больше разница между атомами легирующего металла и металла-основы, тем прочнее образующиеся связи. Металлическая связь как бы дополняется химической.
Легирование, однако, вовсе не последнее слово в решении проблемы жаропрочных сплавов. Уже в наше время обнаружены необычайные свойства нитевидных кристаллов, или «усов». Прочность их по сравнению с металлами, обычно используемыми в технике, поразительно велика. Объясняется это тем, что кристаллическая структура усов практически лишена дефектов, и техника сверхскоростных полетов берет на вооружение усы, создавая с их помощью композиционные жаропрочные материалы. Один из таких материалов — это окись алюминия, армированная молибденовыми усами, другой представляет собой начиненный топ же арматурой технический титан. По сравнению с обычным титаном этот материал может работать в жестких условиях в 1000 раз дольше.
Что можно противопоставить огненному смерчу, обрушивающемуся на космический корабль при входе в плотные слои атмосферы? Прежде всего теплозащитную обмазку и охлаждение. Да, охлаждение, подобное в принципе охлаждению автомобильных двигателей с помощью радиаторов. Только работать здесь должны более энергоемкие процессы. Много тепла нужно на испарение веществ, но еще больше на сублимацию — перевод из твердого состояния непосредственно в газообразное. При высоких температурах сублимировать способны молибден, вольфрам, золото. Покрытие носовой части корабля молибденом или другим из перечисленных (более дорогих) металлов в значительной мере ослабит силу огненного смерча, через который надо пройти возвращаемому аппарату космического корабля.
Другие отрасли
Львиную долю продукции из молибдена, сплавов металла забирают производители радио- и электрических ламп, радиоэлектроники.
Материала хватает и на другие цели:
- Пресс-формы, детали машин для литья сплавов под давлением.
- Электровакуумное производство (рентгеновские трубки).
- Положительный электрод источников тока на основе лития.
- Оболочки деталей ядерных реакторов.
- Нагреватели электропечей, функционирующих в жестких условиях.
- Внешний слой «носового» сегмента корпуса сверхзвуковых самолетов.
- Электроды для выплавки стекла.
- Катализ химических реакций.
- Лаки, краски для фарфора, текстиля, мехов.
Эта продукция создается на основе природных соединений и сплавов металла.
Ассортимент: узлы ракетных (ионных, плазменных) двигателей; обшивка спускаемых аппаратов; теплообменники. Здесь свойства молибдена корректируют сплавы с ниобием и танталом.
Чистый кристаллический Mo используется как компонент зеркал для лазеров специального назначения.
Положительные качества сплава
Полученный состав благодаря своим свойствам, позволил производить из него медицинские инструменты и простые ножи. Высокоуглеродистая, нержавеющая хромовая сталь, куда добавлен молибден с ванадием придают лезвиям:
- Нужный уровень твердости.
- Снижают окисление.
- Долго сохраняют при интенсивном использовании блеск и остроту кромок.
- Устойчивость к износу и коррозии.
- Прочность к механическим повреждениям.
- Легкую заточку.
- Сохранение формы при трении.
- Отсутствие разрушений, сколов.
Справ подобного уровня сгладил грань между штамповкой и ковкой. Новые технологии позволили делать штампованные ножи, которые мало отличаются качеством от ковки. Их вырезают из стальных листов, а после закалки затачивают. На этот процесс уходит меньше времени. Острие получается легким и тонким, они выдерживают много заточек.

Биологическая роль
Физиологическое значение молибдена для организма животных и человека было впервые показано в 1953 году, с открытием влияния этого элемента на активность фермента ксантиноксидазы. Молибден промотирует (делает более эффективной) работу антиокислителей, в том числе витамина С. Важный компонент системы тканевого дыхания. Усиливает синтез аминокислот, улучшает накопление азота. Молибден входит в состав ряда ферментов (альдегидоксидаза, сульфитоксидаза, ксантиноксидаза и др.), выполняющих важные физиологические функции, в частности, регуляцию обмена мочевой кислоты. Молибденоэнзимы катализируют гидроксилирование различных субстратов. Альдегидоксидаза окисляет и нейтрализует различные пиримидины, пурины, птеридины. Ксантиноксидаза катализирует преобразование гипоксантинов в ксантины, а ксантины — в мочевую кислоту. Сульфитоксидаза катализирует преобразование сульфита в сульфат.
Недостаток молибдена в организме сопровождается уменьшением содержания в тканях ксантиноксидазы. При недостатке молибдена страдают анаболические процессы, наблюдается ослабление иммунной системы. Тиомолибдат аммония (растворимая соль молибдена), является антагонистом меди и нарушает её утилизацию в организме.
Круговорот азота
Молибден входит в состав активного центра нитрогеназы — фермента для связывания атмосферного азота (распространён у бактерий и архей).
Микроэлемент
Микроколичества молибдена необходимы для нормального развития организмов, используется в составе микроэлементной подкормки, в частности, под ягодные культуры.
Влияет на размножение (у растений).
Молибден — применение
В настоящее время недостаточно исследований, чтобы оправдать добавление этого микроэлемента. Тем не менее, некоторые люди считают, что добавка молибдена для организма может быть полезна для лечения кандидоза ().
Считается, что этот элемент может быть полезен для некоторых из следующих состояний, но на сегодняшний день имеется ограниченное количество данных для оценки эффективности его применения для решения следующих проблем со здоровьем:
- Рак пищевода — низкий уровень этого минерала может быть связан с повышенным риском рака пищевода, но неизвестно, снижает ли прием добавок этот риск ().
- Заболевание печени.
- ВИЧ / СПИД.
- Грибковые инфекции / кандида.
- Сульфит чувствительность.
- Аллергия и химическая чувствительность.
- Удушье.
- Болезнь Лайма.
- Прыщи.
- Экзема.
- Бессонница.
- Малокровие.
- Паралич Белла.
- Рассеянный склероз.
- Волчанка.
- Болезнь Вильсона.
- Остеопороз.
- Кариес.
Для чего используется молибден в повседневной жизни
Он используется для создания молибденовой смазки (многоцелевой смазки для общепромышленного применения), а также молибденовой стали (материал, применяемый в нефтяной и газовой, энергетической, строительной и автомобильной промышленности для обеспечения своей прочности, устойчивости к коррозии и устойчивости к высоким температурам). Формы, используемые в промышленных целях, включают оксид молибдена, триоксид молибдена, гексакарбонил молибдена и сульфид молибдена.
Кроме того, порошок молибдена используется в качестве растительного удобрения.
Препараты и добавки с Мо
Нехватка молибдена в организме человека может быть опасна, поэтому врач назначает применение специальных лекарственных препаратов.
Обычно это комплексы витаминов и минералов, в капсулах которых содержится суточное количество необходимого вещества
Назначение может преследовать профилактические цели, что важно в период развития простуды и инфекционных заболеваний. Такая терапия нужна для поддержания иммунитета
Эффективными являются следующие комплексы:
| Препарат | Описание |
| Геримакс Энерджи | Основным компонентом является корень женьшеня. Курс приема от 10 до 30 дней. Стоимость упаковки — от 500 до 600 руб. |
| Дуовит | Выпускается в форме драже, упакованных в блистеры. Стоимость упаковки — от 260 руб. Курс приема 20 дней по утрам до приема пищи. |
| Центрум | Продается в таблетках, распакованных в непрозрачные флаконы. Курс лечения около месяца. Стоимость упаковки — от 500 руб. Есть противопоказания, с которыми нужно предварительно ознакомиться. |
| Витрум Юниор | Принимается после еды. Детям дают полтаблетки. Выпускается препарат в таблетках, упакованных в блистеры. Стоимость упаковки — от 445 руб. |
| Мультимакс | Выпускается в таблетках. Запрещен для приема детям до 12-ти лет. Длительность терапии и дозировка определяется врачом. Стоимость упаковки — от 348 руб. |
| Алфавит | В блистере имеются таблетки разного цвета. Их принимают 3 раза в день, каждый раз другой цвет согласно инструкции. Срок терапии около 20 дней. Стоимость — от 185 руб. |
| Алфавит «Мамино здоровье» | Специальный комплекс для будущих мам. Назначается и принимается под присмотром врача. Стоимость — от 150 руб. |
Эти и другие комплексы имеют свои противопоказания и показания к применению. Другие лекарства, содержащие молибден применяются для лечения сложных заболеваний, таких как онкология.
К ним относятся:
- Молибден от производителя Country Life.
- Молибден-99 с радиоактивными изотопами.
Дефицит молибдена — симптомы и признаки
Что вызывает дефицит молибдена? Нехватка молибдена встречается редко, но если он действительно возникает, то обычно приобретается или наследуется.
Диетическая недостаточность этого минерала никогда не наблюдалась у здоровых людей. Однако пациенты с генетическим и тяжелым метаболическим дефектом, называемым дефицитом кофактора молибдена, имеют это состояние ().
Это редкое заболевание приводит к дефициту трех молибдоферментов (сульфитоксидаза, ксантиндегидрогеназа и альдегидоксидаза). Младенец, родившийся с этим дефицитом кофактора, который может выжить, может иметь серьезные неврологические нарушения и целый ряд других нарушений.
Если дефицит все же возникает, это может быть приобретенный дефицит. Это было замечено у одного пациента в 1980-х годах, у которого была болезнь Крона и которая находилась на длительном внутривенном введении пищи без добавления уровней этого минерала.
Для этого пациента симптомы дефицита молибдена включали учащенное сердцебиение и частоту дыхания, головные боли и ночную слепоту. Состояние пациента улучшилось, когда внутривенное питание было прекращено и заменено добавлением молибдена в форме молибдата аммония.
Недостаток молибдена для организма считается крайне редким, поэтому добавка обычно не рекомендуется к приему.